Reaksi Eksoterm Dan Endoterm
 Pelajaran Soal Rumus Reaksi Eksoterm Endoterm
Pelajaran Soal Rumus Reaksi Eksoterm Endoterm
Reaksi Eksoterm adalah
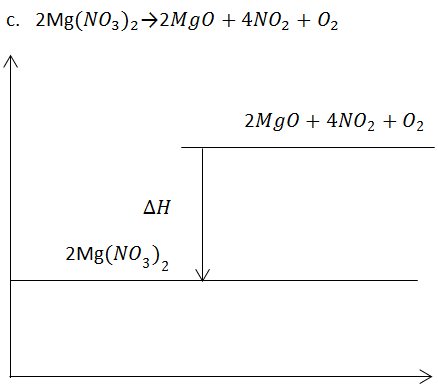
Reaksi Eksoterm – Pengertian, Teori, Perbedaan dan Contoh – Untuk pembahasan kali ini kami akan mengulas mengenai Reaksi Eksoterm yang dimana dalam hal ini meliputi pengertian, teori, perbedaan dan contoh, nah agar dapat lebih memahami dan dimengerti simak ulasan selengkapnya dibawah ini.
Pengertian Reaksi Eksoterm
Reaksi eksoterm adalah reaksi kimia dengan sistem melepaskan kalor. Pada reaksi eksoterm, suhu campuran reaksi akan naik dan energi potensial dari zat-zat kimia yang bersangkutan akan turun sehingga sistem melepaskan kalor ke lingkungannya.
Reaksi eksoterm ada yang terjadi secara alami dan ada yang terjadi secara buatan. Reaksi eksoterm alami merupakan proses reaksi di alam yang berlangsung spontan dengan melepaskan energi. Misalnya, besi berkarat, air mengalir, ledakan bom, pertunjukan kembang api, dan pembakaran kayu.
Baca Juga Artikel yang Mungkin Berkaitan : Asam Sulfat – Pengertian, Sifat, Rumus, Bahaya dan Proses
Rekasi eksoterm buatan merupakan reaksi eksoterm hasil percobaan di laboratorium. Misalnya, reaksi natrium peroksida dengan air, reaksi HCL dan serbuk Zn, pencampuran air dengan asam pekat, penambahan air kedalam tembaga sulfat anhidrat, dan reaksi besi (III) oksida dengan logam aluminium (reaksi termit).
Reaksi eksoterm pada umumnya berlangsung spontan, sedangkan reaksi endoterm tidak.
Pada reaksi endoterm : DH = Hp – Hr > 0 ( bertanda positif )
Pada reaksi eksoterm : DH = Hp – Hr < 0 ( bertanda negatif )
Pada reaksi eksoterm , sistem membebaskan energi, sehingga entalpi sistem akan berkurang, artinya entalpi produk lebih kecil daripada entalpi pereaksi. Oleh karena itu , perubahan entalpinya bertanda negatif.
Perubahan entalpi pada reaksi eksoterm dapat dinyatakan dengan diagram tingkat energi seperti berikut ini:
Teori-Teori Reaksi Eksoterm
Reaksi kimia seperti pembakaran, fermentasi, dan reduksi dari bijih menjadi logam sudah diketahui sejak dahulu kala. Teori-teori awal transformasi dari material-material ini dikembangkan oleh filsuf Yunani Kuno, seperti Teori empat elemen dari Empedocles yang menyatakan bahwa substansi apapun itu tersusun dari 4 elemen dasar: api, air, udara, dan bumi. Di abad pertengahan, transformasi kimia dipelajari oleh para alkemis. Mereka mencoba, misalnya, mengubah timbal menjadi emas, dengan mereaksikan timbal dengan campuran tembaga-timbal dengan sulfur.
Baca Juga Artikel yang Mungkin Berkaitan : Etanol – Pengertian, Msds, Rumus, Struktur, Bahaya, pH & Pembuatannya
Produksi dari senyawa-senyawa kimia yang tidak terdapat secara alami di bumi telah lama dicoba oleh para ilmuwan, seperti sintesis dari asam sulfur dan asam nitrat oleh alkemis Jābir ibn Hayyān. Proses ini dilakukan dengan cara memanaskan mineral-mineral sulfat dan nitrat, seperti tembaga sulfat, alum dan kalium nitrat. Pada abad ke-17, Johann Rudolph Glauber memproduksi asam klorida dan natrium sulfat dengan mereaksikan asam sulfat dengan natrium klorida.
Dengan adanya pengembangan lead chamber process pada tahun 1746 dan proses Leblanc, sehingga memungkinkan adanya produksi asam sulfat dan natrium karbonat dalam jumlah besar, maka reaksi kimia dapat diaplikasikan dalam industri. Teknologi asam sulfat yang semakin maju akhirnya menghasilkan proses kontak di tahun 1880-an, dan proses Haber dikembangkan pada tahun 1909–1910 untuk sintesis amonia.
Dari abad ke-16, sejumlah peneliti seperti Jan Baptist van Helmont, Robert Boyle dan Isaac Newton mencoba untuk menemukan teori-teori dari transformasi-transformasi kimia yang sudah dieksperimenkan. Teori plogiston dicetuskan pada tahun 1667 oleh Johann Joachim Becher.
Teori itu mempostulatkan adanya elemen seperti api yang disebut “plogiston”, yang terdapat dalam benda-benda yang dapat terbakar dan dilepaskan selama pembakaran. Teori ini dibuktikan salah pada tahun 1785 oleh Antoine Lavoisier, yang akhirnya memberikan penjelasan yang benar tentang pembakaran.
Pada tahun 1808, Joseph Louis Gay-Lussac akhirnya mengetahui bahwa karakteristik gas selalu sama. Berdasarkan hal ini dan teori atom dari John Dalton, Joseph Proust akhrinya mengembangkan hukum perbandingan tetap yang nantinya menjadi konsep awal dari stoikiometri dan persamaan reaksi.
Pada bagian kimia organik, telah lama dipercaya bahwa senyawa yang terdapat pada organisme yang hidup itu terlalu kompleks untuk bisa didapatkan melalui sintesis kimia. Menurut konsep vitalisme, senyawa organik dilengkapi dengan “kemampuan vital” sehingga “berbeda” dari material-material inorganik.
Baca Juga Artikel yang Mungkin Berkaitan : Amonia – Pengertian, Rumus, Proses, Sifat, Dampak dan Cara
Tapi pada akhirnya, konsep ini pun berhasil dipatahkan setelah Friedrich Wöhler berhasil mensintesis urea pada tahun 1828. Kimiawan lainnya yang memiliki kontribusi terhadap ilmu kimia organik di antaranya Alexander William Williamson dengan sintesis eter yang dilakukannya dan Christopher Kelk Ingold yang menemukan mekanisme dari reaksi subs.
Contoh Penulisan Persamaan Reaksi dalam Termokimia
C(s) + O2(g) ® CO2(g) + 394 kJ
2 C(s) + H2(g) ® C2H2(g) – 226,8 kJ
Ditulis:
C(s) + O2(g) ® CO2(g) AH = –394 kJ
2 C(s) + H2(g) ® C2H2(g) AH = +226,8 kJ
Perbedaan Reaksi Eksoterm dan Reaksi Endoterm
Terdiri dari:
→ Reaksi Eksoterm
- Membebaskan kalor
- Suhu sistem lebih tinggi dibandingkan Suhu lingkungan
- Kalor berpindah dari sistem ke lingkungan
- Entalpi sistem akan berkurang
- Mengalami kenaikan suhu
→ Reaksi Endoterm
- Memerlukan kalor
- Suhu sistem lebih rendah dibandingkan suhu lingkungan
- Kalor berpindah dari lingkungan ke sistem
- Entalpi sistem akan bertambah
- Mengalami penurunan suhu
Baca Juga Artikel yang Mungkin Berkaitan : Koloid adalah
Contoh Reaksi Eksoterm dalam Kehidupan Sehari-Hari
Terdiri atas:
Demikianlah pembahasan mengenai Reaksi Eksoterm – Pengertian, Teori, Perbedaan dan Contoh semoga dengan adanya ulasan tersebut dapat menambah wawasan dan pengetahuan anda semua, terima kasih banyak atas kunjungannya. 🙂 🙂 🙂
Gallery Reaksi Eksoterm Dan Endoterm
 Teori Reaksi Eksoterm Dan Endoterm
Teori Reaksi Eksoterm Dan Endoterm
 Laporan Kimia Reaksi Ekso Dan Endoterm
Laporan Kimia Reaksi Ekso Dan Endoterm
 Soal Reaksi Eksoterm Dan Endoterm Termokimia Part 14
Soal Reaksi Eksoterm Dan Endoterm Termokimia Part 14
 Kimia Sma Perbedaan Reaksi Eksoterm Dan Endoterm
Kimia Sma Perbedaan Reaksi Eksoterm Dan Endoterm
 Pdf Rpp Rx Ekso Endo Pdf Liinah Safiin Academia Edu
Pdf Rpp Rx Ekso Endo Pdf Liinah Safiin Academia Edu
 Percobaan Reaksi Kimia Eksoterm Dan Endoterm Kelompok 1 Xi Mia 1 Sma Negeri 5 Batanghari
Percobaan Reaksi Kimia Eksoterm Dan Endoterm Kelompok 1 Xi Mia 1 Sma Negeri 5 Batanghari
 Standards S Questions Q And Level Of Understanding
Standards S Questions Q And Level Of Understanding
 Pelajaran Soal Rumus Reaksi Eksoterm Endoterm
Pelajaran Soal Rumus Reaksi Eksoterm Endoterm
 Reaksi Eksoterm Dan Endoterm Doc Document
Reaksi Eksoterm Dan Endoterm Doc Document
 Reaksi Eksoterm Dan Reaksi Endoterm Laporan Praktikum
Reaksi Eksoterm Dan Reaksi Endoterm Laporan Praktikum
 Kisi Kisi Usbn Smk Kimia K2013 Pdf Google Drive
Kisi Kisi Usbn Smk Kimia K2013 Pdf Google Drive
 Laporan Praktikum Kimia Reaksi Eksoterm Dan Endoterm
Laporan Praktikum Kimia Reaksi Eksoterm Dan Endoterm
 Praktikum Reaksi Eksoterm Dan Endoterm
Praktikum Reaksi Eksoterm Dan Endoterm
 Reaksi Eksoterm Dan Reaksi Docx Docx Document
Reaksi Eksoterm Dan Reaksi Docx Docx Document








0 Response to "Reaksi Eksoterm Dan Endoterm"
Post a Comment