Gaya Van Der Waals
 Gaya Van Der Waals Literasi Kimia
Gaya Van Der Waals Literasi Kimia
Pengertian Gaya Van der Waals, Klasifikasi dan Contohnya

Gaya Van der Waals, istilah ini mungkin asing di telinga sebagian orang, tetapi bagi para pelajar, mahasiswa, peneliti dan ilmuwan sudah familiar. Agar lebih memahami apa yang dimaksud dengan Gaya Van der Waals, bisa simak uraian di bawah ini.
Gaya van der Waals dalam ilmu kimia merujuk pada jenis gaya antara molekul. Istilah ini pada awalnya merujuk pada jenis gaya antarmolekul, dan hingga saat ini masih digunakan dalam pengertian tersebut, tetapi saat ini lebih umum merujuk pada gaya-gaya yang timbul dari polarisasi molekul menjadi dipol. Hal ini mencakup gaya yang timbul dari dipol tetap (gaya Keesom), dipol rotasi atau bebas (gaya Debye) serta pergeseran distribusi awan elektron (gaya London).
Gaya ini dikemukakan pertama kali oleh Johannes van der Waals (1837-1923). Gaya Van der Waals merupakan gaya tarik menarik listrik yang relatif lemah akibat kepolaran molekul yang permanen atau terinduksi. Kepolaran permanen terjadi akibat kepolaran di dalam molekul, sedangkan kepolaran tidak permanen terjadi akibat molekul terinduksi oleh partikel lain yang bermuatan sehingga molekul bersifat polar sesaat secara spontan. Potensial Lennard-Jones sering digunakan sebagai model hampiran untuk gaya van der Waals sebagai fungsi dari waktu.
Konsep gaya tarik menarik antar molekul ini digunakan untuk menurunkan persamaan zat-zat yang berada dalam fase gas. Gaya ini terjadi karena adanya gaya tarik menarik antara inti atom dengan elektron atom lain yang disebut gaya tarik menarik elektrostatis (gaya coulomb) yang umumnya terdapat pada senyawa polar. Pada molekul non polar gaya Van Der Waals timbul karena adanya dipol-dipol sesaat atau gaya London.
Interaksi van der Waals teramati pada gas mulia, yang amat stabil dan cenderung tak berinteraksi. Hal ini menjelaskan sulitnya gas mulia untuk mengembun. Tetapi, makin besar ukuran atom gas mulia (makin banyak elektronnya) makin mudah gas tersebut berubah menjadi cairan.
Berdasarkan kepolaran partikelnya gaya Van Der Waals dibagi menjadi :
- Interaksi ion-dipol (molekul polar)
- Interaksi dipol-dipol
- Interaksi ion-dipol terinduksi
- Interaksi dipol-dipol terinduksi
Interaksi ion-dipol (molekul polar)
Terjadi interaksi/tarik menarik antara ion dengan molekul polar (dipol) yang relatf cukup kuat . Dapat dilihat berdasarkan Mr (massa molekul relatif) semakin besar Mr semakin besar gaya ion dipol. Rumus = Mr x jumlah total ion molekul
Gaya antarmolekul ini terjadi antara ion dan senyawa kovalen polar. Ketika dilarutkan dalam senyawa kovalen polar, senyawa ion akan terionisasi menjadi ion positif dan ion negatif. Ion positif akan tarik menarik dengan dipol negatif, dan sebaliknya. Selain gaya ion-dipol, juga dikenal gaya ion-dipol sesaat, dimana terjadi dari interaksi antar gaya dipol-dipol terinduksi dengan gaya ion-dipol. Jika ion dari senyawa ion berdekatan dengan molekul nonpolar, ion tersebut dapat menginduksi dipol molekul nonpolar. Dipol terinduksi molekul nonpolar yang dihasilkan akan berikatan dengan ion.
Gaya Ion-dipol
Interaksi ion – dipol merupakan interaksi (berikatan) / tarik menarik antara ion dengan molekul polar (dipol). Interaksi ini termasuk jenis interaksi yang relatif cukup kuat.
Contoh : H+ + H2O → H3O+
Ag+ + NH3 → Ag(NH3)+
Sebagai contoh, NaCl (senyawa ion) dapat larut dalam air (pelarut polar) dan AgBr (senyawa ion) dapat larut dalam NH3 (pelarut polar).
Interaksi dipol-dipol
Merupakan interaksi antara sesama molekul polar (dipol) yang terjadi antara ekor dan kepala dari molekul itu sendiri. Interaksi dipol – dipol merupakan interaksi antara sesama molekul polar (dipol). Interaksi ini terjadi antara ekor dan kepala dimana jika berlawanan kutub maka akan tarik-menarik dan sebaliknya. Tanda “+” menunjukkan dipol positif, tanda “-” menunjukkan dipol negatif
Molekul seperti HCl memiliki dipol permanen karena klor lebih elektronegatif dibandingkan hidrogen. Kondisi permanen ini, pada saat pembentukan dipol akan menyebabkan molekul saling tarik menarik satu sama lain. Molekul yang memiliki dipol permanen akan memiliki titik didih yang lebih tinggi dibandingkan dengan molekul yang hanya memiliki dipol yang berubah-ubah secara sementara.
Agak mengherankan dayatarik dipol-dipol agak sedikit dibandingkan dengan gaya dispersi, dan pengaruhnya hanya dapat dilihat jika kamu membandingkan dua atom dengan jumlah elektron yang sama dan ukuran yang sama pula. Sebagai contoh, titik didih etana, CH3CH3, dan fluorometana, CH3F adalah:
Keduanya memiliki jumlah elektron yang identik, dan ukurannya hampir sama – seperti yang terlihat pada diagram. Hal ini berarti bahwa gaya dispersi kedua molekul adalah sama. Titik didih fluorometana yang lebih tinggi berdasarkan pada dipol permanen yang besar yang terjadi pada molekul karena elektronegatifitas fluor yang tinggi. Akan tetapi, walaupun memberikan polaritas permanen yang besar pada molekul, titik didih hanya meningkat kira-kira 10°.
Berikut ini contoh yang lain yang menunjukkan dominannya gaya dispersi. Triklorometan, CHCl3, merupakan molekul dengan gaya dispersi yang tinggi karena elektronegatifitas tiga klor. Hal itu menyebabkan dayatarik dipol-dipol lebih kuat antara satu molekul dengan tetangganya. Di lain pihak, tetraklorometan, CCl4, adalah non polar. Bagian luar molekul tidak seragam – in pada semua arah. CCl4 hanya bergantung pada gaya disperse.
Interaksi ion-dipol terinduksi
Merupakan interaksi ion dengan dipol terinduksi. Dipol terinduksi merupakan molekul netral dan menjadi dipol akibat induksi partikel bermuatan yang berada di dekatnya. Ikatan ini relatif lemah karena kepolaran molekul terinduksi relatif kecil daripada dipol permanen.
Interaksi ion – dipol terinduksi merupakan interaksi antara aksi ion dengan dipol terinduksi. Dipol terinduksi merupakan molekul netral yang menjadi dipol akibat induksi partikel bermuatan yang berada didekatnya. Partikel penginduksi tersebut dapat berupa ion atau dipol lain dimana kemampuan menginduksi ion lebih besar daripada kemampuan menginduksi dipol karena muatan ion yang juga jauh lebih besar. Interaksi ini relatif lemah karena kepolaran molekul terinduksi relatif kecil daripada dipol permanen. Contoh : I– + I2 → I3
Interaksi dipol-dipol terinduksi
Molekul dipol dapat membuat molekul netral lain yang bersifat dipol terinduksi sehingga terjadi interaksi dipol-dipol terinduksi dan ikatannya relatif lemah sehingga prosesnya berlangsung secara lambat.Antar aksi dipol terinduksi-dipol terinduksi (gaya london)
Gaya Van der Waals bersifat permanen sehingga lebih kuat dari gaya london. Gaya Van Der Waals terdapat pada senyawa Hidrokarbon seperti CH4. Perbedaan keelektronegatifan C(2,5) dengan H(2,1) sangat kecil, yaitu 0,4. Senyawa-senyawa yang memiliki ikatan Van Der Waals akan mempunyai titik didih yng sangat rendah, tetapi akan semakin tinggi apabila Mr bertambah karena ikatan akan semakin kuat (C4H10 > C3H8 > C2 H6> CH4).
Suatu molekul polar yang berdekatan dengan molekul nonpolar, akan dapat menginduksi molekul nonpolar. Akibatnya. Molekul nonpolar memiliki dipol terinduksi. Dipol dari molekul polar akan saling tarik-menarik dengan dipol terinduksi dari molekul nonpolar. Contohnya terjadi pada interaksi antara HCl (molekul polar) dengan Cl2 (molekul nonpolar).
Gallery Gaya Van Der Waals
 Bentuk Molekul Contoh Bentuk Gaya Ikatan Kimia
Bentuk Molekul Contoh Bentuk Gaya Ikatan Kimia
 Thermal Electron Attachment To Van Der Waals Molecules
Thermal Electron Attachment To Van Der Waals Molecules
 Apa Kekuatan Van Der Waals Kimia Thpanorama Jadikan
Apa Kekuatan Van Der Waals Kimia Thpanorama Jadikan
 Doc Gaya Van Der Walls Echa Buludawa Academia Edu
Doc Gaya Van Der Walls Echa Buludawa Academia Edu
 Ikatan Hidrogen Dan Gaya Van Der Walls Konsep Mudah
Ikatan Hidrogen Dan Gaya Van Der Walls Konsep Mudah
 Pengertian Gaya Van Der Waals Dan Jenisnya Pembahasan
Pengertian Gaya Van Der Waals Dan Jenisnya Pembahasan
 Thermodynamics 47 Van Der Waals 2 2
Thermodynamics 47 Van Der Waals 2 2
 Van Der Waals Heterostructures
Van Der Waals Heterostructures
 Kimia 2 Pptx Gaya Dipol Dipol Adalah Singkatan Dari Di
Kimia 2 Pptx Gaya Dipol Dipol Adalah Singkatan Dari Di
 Van Der Waals Gaya Lemak Fosfolipid Gambar Png
Van Der Waals Gaya Lemak Fosfolipid Gambar Png
 File Argon Dimer Potential Png Wikimedia Commons
File Argon Dimer Potential Png Wikimedia Commons
 Ppt Gaya Intra Antar Molekul Kelas Xi Semester 1
Ppt Gaya Intra Antar Molekul Kelas Xi Semester 1
 Gaya Antarmolekul Dipol Dipol Gaya London Dan Kekuatan
Gaya Antarmolekul Dipol Dipol Gaya London Dan Kekuatan
 Van Der Waals Heterostructures
Van Der Waals Heterostructures

 Pengertian Ikatan Kimia Jenis Contoh Ikatan Kimia
Pengertian Ikatan Kimia Jenis Contoh Ikatan Kimia
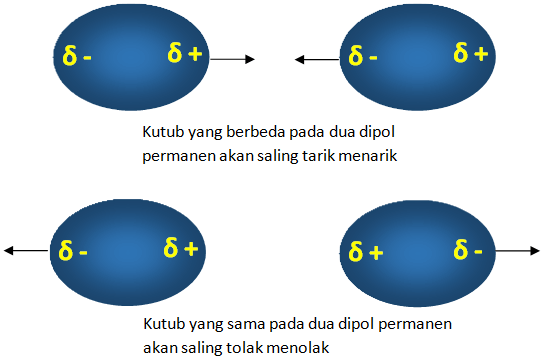 Macam Macam Gaya Antar Molekul Beserta Contohnya Siswapedia
Macam Macam Gaya Antar Molekul Beserta Contohnya Siswapedia
 In Van Der Waals Equation Of Gases The Kinetic Equation For
In Van Der Waals Equation Of Gases The Kinetic Equation For
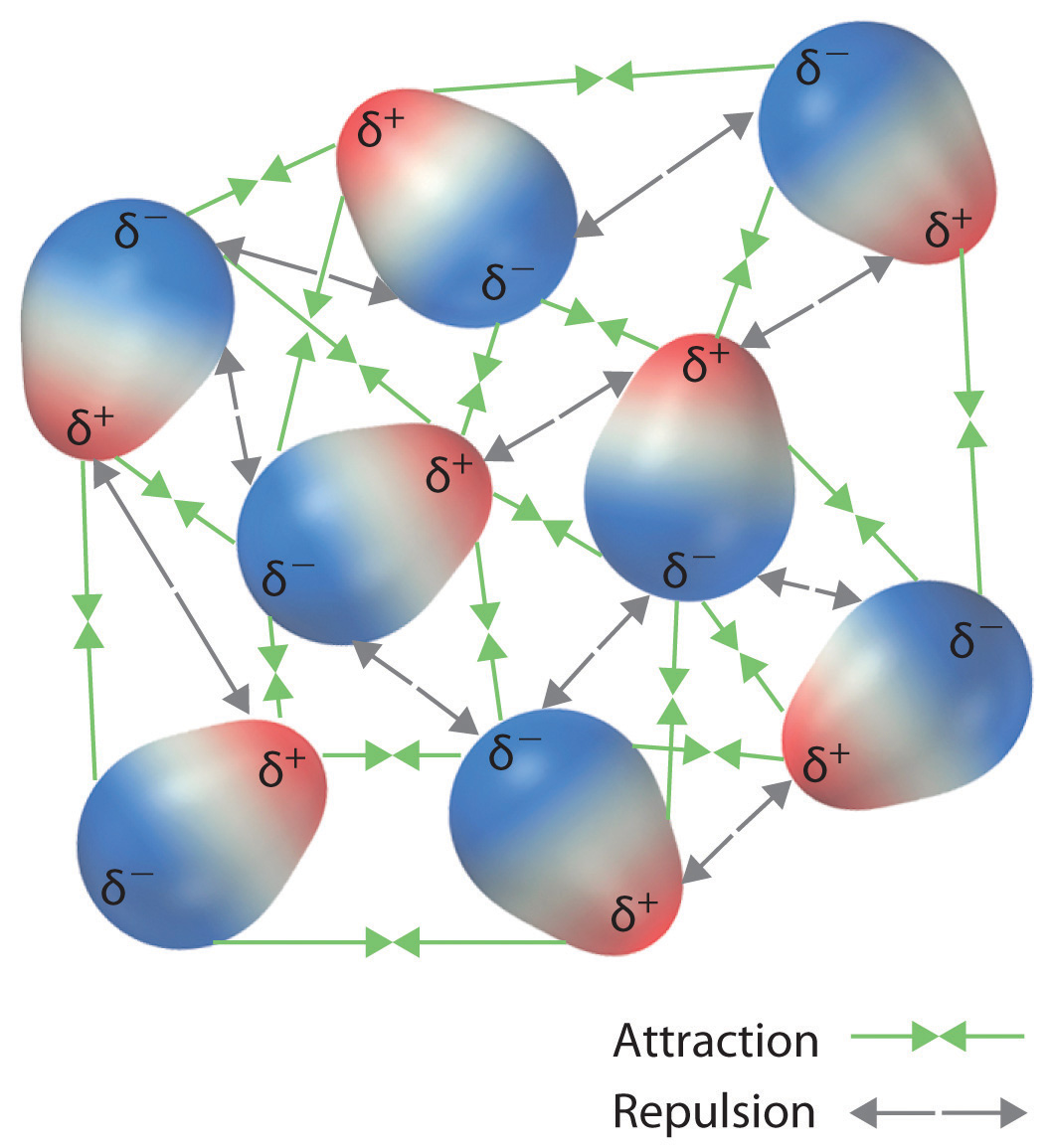 12 6 Types Of Intermolecular Forces Dispersion Dipole
12 6 Types Of Intermolecular Forces Dispersion Dipole
 Pengertian Gaya Van Der Waals Jenis Karakteristik Contoh
Pengertian Gaya Van Der Waals Jenis Karakteristik Contoh





0 Response to "Gaya Van Der Waals"
Post a Comment