 Pengertian Larutan Asam Basa Contoh Serta Indikator Asam
Pengertian Larutan Asam Basa Contoh Serta Indikator Asam
Asam Basa : Pengertian, Teori, Contoh Soal beserta Pembahasannya

Pada postingan ini, sesuai judulnya. Saya akan mengupas habis semua yang berkaitan tentang asam basa. Diantaranya membahas tentang pengertian asam basa, perkembangan teori-teori asam basa, beserta beberapa contoh soal dan pembahasan. Gambar 1. Indikator asam basa
Secara umum suatu zat dikatakan asam yaitu jika memiliki pH kurang dari 7, sedangkan basa jika memiliki pH lebih dari 7. Untuk mengetahui suatu zat tersebut bersifat asam atau basa bisa dengan menggunakan indikator sederhana, indikator tersebut ialah dengan menggunakan kertas lakmus. (Lihat Gambar 1) Jika kertas lakmus merah berubah menjadi biru artinya larutan tersebut bersifat basa, sedangkan jika lakmus biru berubah menjadi merah artinya larutan tersebut bersifat asam. Untuk mengukur kekuatan asam basa bisa digunakan pH meter atau pH paper universal. Pada pH meter, ketelitian yang didapat hingga dua angka desimal, sedangkan pada pH paper universal ketelitiannya hanya satu digit saja. Maka dari itu penggunaan dari pengukur pH tersebut disesuaikan dengan kebutuhan. Jika kebutuhannya untuk mendapatkan nilai pH yang lebih akurat sebaiknya menggunakan pH meter.
Asam dapat didefinisikan juga sebagai zat yang jika dilarutkan dalam air akan mengalami disosiasi dan menghasilkan kation hidrogen (H+), sedangkan basa didefinisikan sebagai zat yang jika dilarutkan dalam air akan mengalami disosiasi dan menghasilkan anion hidroksida (OH-).
Contoh reaksi disosiasi asam basa adalah sebagai berikut
Definisi tersebut didasarkan pada teori Arrhenius pada tahun 1884. Namun teori tersebut masih memiliki kelemahan, yaitu tidak menjelaskan tentang pengaruh pelarut dan tentang garam. Kemudian munculah berbagai teori untuk melengkapi teori dari Arrhenius tersebut. Nanti bisa anda lihat pada Bab kedua tentang teori-teori asam basa.
Perkembangan teori-teori asam basa diawali dari Arrhenius (1884), Bronsted - Lowry (1923) , Lewis (1923). Menurut Svante August Arrhenius (1884) asam adalah spesi yang jika dilarutkan dalam air akan terdisosiasi menghasilkan ion H+ dan basa adalah spesi yang jika dilarutkan dalam air akan terdisosiasi menghasilkan ion OH-, dengan asumsi bahwa pelarut tidak berpengaruh terhadap sifat asam dan basa. Dalam pengajuan desertasinya, Arrhenius mengalami hambatan yang cukup berat karena profesornya tidak tertarik. Desertasinya dimulai pada tahun 1880, diajukan pada 1883. Kemudian dia diluluskan, namun dengan nilai yang rendah, bahkan hampir tidak lulus. Hal tersebut dikarenakan teorinya yang dianggap terlalu revolusioner, dianggap tidak realistis dan sebagainya. Dia melanjutkan penelitian tentang teorinya dengan Ostwald dan Kohlrausch pada tahun 1886, kemudian dilanjutkan dengan Boltzmann dan van't Hoff pada tahun 1887. Hingga akhirnya Arrhenius mampu membuktikan teori-teorinya, dan kemudian juga diterbitkan karangannya mengenai asam basa. Akhirnya dunia mengakui teori Arrhenius, dan pada tahun 1903 mendapatkan hadiah nobel untuk ilmu pengetahuan. Sampai sekarang teori Arrhenius masih tetap berguna meskipun hal tersebut merupakan model paling sederhana. Dalam membedakan asam basa lemah atau kuat didasarkan pada daya hantar listrik molal. Jika suatu larutan dapat menghantarkan listrik artinya larutan tersebut mengandung ion. Semakin kuat daya hantar listriknya artinya semakin kuat pula sifat asam atau basanya. Karena semakin banyak asam/basa yang terionisasi membuat larutan tersebut semakin elektrolit kuat. Sehingga bisa disimpulkan bahwa asam/basa kuat berupa elektrolit kuat dan asam/basa lemah merupakan elektrolit lemah. Tentunya teori Arrhenius tersebut masih memiliki beberapa kekurangan, misalnya belum menjelaskan tentang bagaimana pengaruh dari pelarut, atau bagaimana dengan sifat garam. Maka dari itu beberapa peneliti kemudian memberikan usulan teori lagi tentang asam basa. Asam Arrhenius Menurut Arrhenius, suatu zat dikatakan asam jika dilarutkan dalam air akan menghasilkan ion H+, sebagai contoh yaitu disosiasi dari HCl. Ketika HCl dibuat menjadi larutan, maka HCl terdisosiasi menjadi ion H+ dan ion Cl-. Karena sesuai dengan teori Arrhenius maka asam klorida termasuk asam Arrhenius. Contoh lain dari asam Arrhenius bisa dilihat pada tabel berikut : Dari berbagai contoh di atas hasil dari disosiasi berupa ion H+, namun pada kenyataannya ion H+ tidak ada yang berupa ion bebas. ion H+ akan bereaksi dengan molekul air di sekitarnya, membentuk ion H3O+. H+(aq)+H2O(l)→H3O+(aq) Sehingga reaksi lengkap yang terjadi pada disosiasi adalah sebagai berikut : Namun untuk menyingkatnya agar lebih pendek dan lebih mudah diingat reaksi disosiasi menjadi sebagai berikut : ![]()
Secara umum, tidak ada yang salah untuk penggunaan kedua reaksi di atas dalam menunjukkan disosiasi.
Menurut Arrhenius, suatu zat dikatakan basa jika dilarutkan dalam air akan menghasilkan ion OH-, sebagai contoh yaitu disosiasi dari NaOH.
![]()
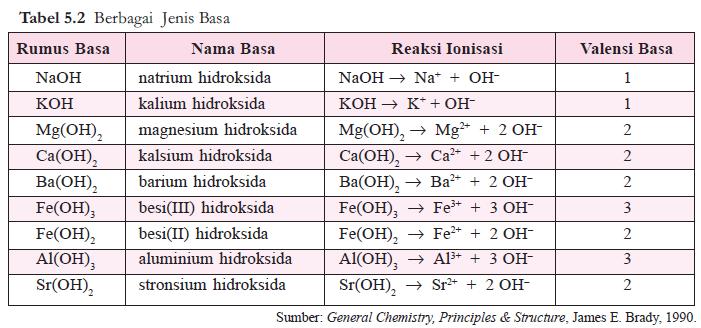
Ketika NaOH dibuat menjadi larutan, maka NaOH terdisosiasi menjadi ion Na+ dan ion OH-. Karena sesuai dengan teori Arrhenius maka larutan Natrium Hidroksida termasuk basa Arrhenius. Contoh lain dari basa Arrhenius bisa dilihat pada tabel berikut : Dari beberapa contoh di atas, kebanyakan terlihat bahwa ion OH- berasal dari suatu zat yang dilarutkan tersebut. Namun jangan terkecoh, untuk beberapa zat yang tanpa gugus OH- pada rumus kimianya pun juga dapat bersifat basa, asalkan ketika dilarutkan dalam air menghasilkan ion OH-. Sebagai contoh yaitu senyawa amonia, dengan rumus kimia NH3. Amonia juga merupakan suatu basa, karena ketika dilarutkan dalam air membuat terbentuknya ion OH-. Silakan lihat bagaimana reaksi pelarutannya pada gambar berikut: NH3(aq)+H2O(l)⇋NH4+(aq)+OH−(aq) Karena dapat menghasilkan ion OH- ketika dilarutkan dalam air maka amonia termasuk basa Arrhenius, namun pada beberapa buku terdapat pernyataan bahwa basa Arrhenius setidaknya memiliki gugus OH pada rumus kimianya, sehingga jika dikaitkan dengan pernyataan tersebut amonia bukanlah basa arrhenius. Mana yang betul? Kalau menurut penulis sendiri amonia termasuk basa Arrhenius. Karena memenuhi teori dari Arrhenius sendiri.
Teori ini melengkapi teori Arrhenius yang mana belum menjelaskan tentang pengaruh pelarut. Pada teori Arrhenius suatu zat dikatakan asam atau basa jika dilarutkan dalam air menghasilkan ion H+ atau ion OH-, namun bagaimana jika pelarutnya bukan air? Misalnya suatu asam asetat pada pelarut benzena, disitu sifat asamnya menjadi tidak muncul. Lalu pada suatu amonia yang dilarutkan pada Natrium amida, disitu dia menjadi bersifat basa meskipun tidak terbentuk ion OH- karena hal tersebut maka Johannes N. Bronsted dan Thommas M. Lowry menyimpulkan bahwa yang menjadikan suatu zat tersebut suatu asam atau basa yaitu ion H+ atau proton. Menurut Bronsted-Lowry suatu spesi dikatakan asam jika dapat mendonorkan ion H+ atau proton (donor proton) ke spesi lain, sedangkan basa jika spesi tersebut dapat menerima ion H+ atau proton (akseptor proton) dari spesi lain. Asam-basa Konjugasi Kelanjutan dari teori Bronsted-Lowry adalah spesi yang telah mendonorkan proton, akan memiliki kemampuan untuk dapat menerima proton, sehingga merupakan basa. Untuk basa yang terjadi karena hasil dari donor proton biasa disebut basa konjugasi dari asam semula. Sedangkan untuk spesi yang menerima proton, akan memiliki kemampuan untuk mendonorkan proton, dan biasa disebut asam konjugasi dari basa semula. Lebih jelasnya silakan liat gambar berikut: Reaksi HCl dan air Pada reaksi tersebut HCl mendonorkan proton kepada air, sehingga mengacu pada teori Bronsted-Lowry maka HCl tersebut merupakan asam. Namun setelah HCl mendonorkan proton, yang tersisa adalah ion Cl-, yang mana memiliki kemampuan untuk menerima proton atau suatu basa. Maka dari itu Cl-, merupakan basa konjugasi dari HCl. Pasangan asam basa konjugasi = HCl dan Cl- Kemudian karena air menerima proton dari HCl, sehingga air tersebut merupakan basa. Setelah air menerima proton, akan terbentuk ion H3O+, yang mana memiliki kemampuan untuk mendonorkan proton atau suatu asam. Maka dari itu ion H3O+ merupakan asam konjugasi dari air. Pasangan basa asam konjugasi = air dan H3O+. Contoh lain yaitu pada reaksi amonia dan air Pada reaksi tersebut air mendonorkan proton kepada amonia, sehingga air bersifat asam. Setelah air mendonorkan proton, yang tersisa adalah OH-, yang mana memiliki kemampuan untuk menerima proton (basa konjugasi dari air). Amonia menerima proton dari air, sehingga suatu basa. Namun setelah menerima proton, terbentuk NH4+ yang memiliki kemampuan mendonorkan proton (asam konjugasi dari amonia) Pasangan asam basa konjugasi = air dan NH4+ Pasangan basa asam konjugasi = amonia dan OH- Pada contoh pertama (HCl dan air) dan contoh kedua (amonia dan air), terlihat bahwa air memiliki dua sifat, yaitu bisa basa (pada contoh pertama) dan juga asam (pada contoh kedua). Karena sifat tersebut makanya air termasuk dalam golongan senyawa amfoter. Tentang amfoter akan saya jelaskan di sub bab berikutnya Amfoter Senyawa amfoter ini adalah senyawa yang dapat menjadi asam maupun basa, tergantung bagaimana kondisi lingkungannya. Hal ini karena senyawa amfoter memiliki kemampuan seperti itu. Kemampuan itu dapat terjadi karena pada senyawa amfoter terdapat atom hidrogen yang bisa lepas menjadi proton dan juga memiliki pasangan elektron bebas yang dapat menerima proton. Contoh dari senyawa amfoter antara lain air, asam amino, protein, Al(OH)3, serta beberapa logam oksida (ZnO, PbO, SnO dsb) Istilah amfoter berasal dari bahasa yunani "amphoteroi" yang berarti keduanya. Penggunaannya untuk hal asam basa, amfoter artinya senyawa yang dapat menjadi keduanya. Terkadang istilah lain yang juga digunakan untuk senyawa yang dapat menjadi asam maupun basa ialah amfiprotik. Maknanya sama saja antara amfoter maupun amfiprotik. Catatan
Pada teori asam basa Bronsted-Lowry bisa diambil beberapa poin, diantaranya - Asam merupakan spesi yang dapat mendonorkan ion H+ atau proton
- Basa merupakan spesi yang dapat menerima ion H+ atau proton
- Air merupakan senyawa amfoter
- Asam konjugasi adalah asam hasil dari suatu senyawa yang telah menerima proton
- Basa konjugasi adalah basa hasil dari suatu senyawa yang telah mendonorkan proton
C. Teori asam basa menurut Lewis (1923)
Pada tahun yang sama (1923), Lewis mengajukan pandangan yang berbeda terhadap teori asam basa. Ketika Bronsted-Lowry memandang bahwa yang berperan dalam suatu senyawa berupa asam/basa karena suatu proton (ion H+), Lewis memandang bahwa yang berperan dalam sifat asam / basa suatu senyawa adalah karena pasangan elektron.
Pada teori asam basa Lewis, basa mendonorkan pasangan elektron dan asam menerima pasangan elektron.
Asam Lewis adalah semua zat yang dapat menerima pasangan elektron bebas, dengan kata lain suatu akseptor pasangan elektron. Sedangkan basa Lewis adalah zat yang dapat mendonorkan pasangan elektron bebas, dengan kata lain suatu donor pasangan elektron.
Asam Lewis adalah penerima pasangan elektron. Asam Lewis merupakan elektrofil, karena tertarik pada elektron. Asam Lewis bermuatan positif (parsial) pada suatu senyawa. Contoh zat yang termasuk dalam asam Lewis yaitu - semua kation (Cu2+, Na+, Ca2+, Li+, Mg2+, dll),
- atom, ion, atau molekul yang oktet tidak lengkap (BF3, AlF3)
- molekul yang mana atom pusatnya dapat memiliki elektron valensi lebih dari 8 (SiBr4, SiF4)
- molekul memiliki ikatan rangkap dengan dua atom elektronegatif (CO2)
Basa Lewis adalah pendonor pasangan elektron. Basa Lewis merupakan nukleofil, karena menyukai untuk menyerang atom yang bermuatan positif pada suatu senyawa. Contoh zat yang termasuk dalam basa Lewis yaitu OH-, CN-, NH3, dll.
Untuk lebih jelas memahami asam-basa Lewis silakan lihat gambar berikut :
Pada gambar di atas terlihat bahwa NH3 mendonorkan pasangan elektronnya untuk berikatan dengan H+, maka dari itu yang bertindak sebagai basa Lewis adalah NH3. sedangkan H+ menerima pasangan elektron dari amonia, sehingga H+ merupakan asam Lewis. Reaksi BF3 dan NH3. Pada reaksi BF3 dan NH3 yang berperan sebagai basa Lewis adalah amonia, karena NH3 mendonorkan pasangan elektronnya untuk berikatan. Sedangkan yang berperan sebagai asam Lewis yaitu BF3.
Secara umum, asam atau basa dapat diketahui melalui berbagai sifat-sifatnya. Berikut ini akan disajikan beberapa sifat-sifat asam dan basa :
| | |
| | |
Dapat merubah warna indikator misalnya kertas lamus biru menjadi merah | Dapat merubah warna indikator kertas lakmus merah menjadi biru |
Bersifat korosif terhadap logam | Bersifat kaustik artinya dapat merusak kulit |
Dapat menghantarkan listrik (konduktor) | Dapat menghantarkan arus listrik (konduktor) |
Jika dilarutkan ke dalam air menghasilkan ion H+ | Jika dilarutkan ke dalam air menghasilkan ion OH- |
Memiliki nilai pH (derajat keasaman) kurang dari 7 | |
Semakin kecil nilai pH suatu zat maka semakin kuat sifat keasamannya | Semakin besar nilah pH suatu zat maka semakin kuat derajat kebasaanya |
| | Terasa licin jika terkena air, misalnya sabun |
Untuk rumus asam basa dibagi menjadi beberapa fokus pembahasan, diantaranya rumus menentukan pH dari asam basa kuat dan lemah, rumus untuk larutan penyangga, serta rumus untuk hidrolisis garam. Namun untuk penjelasannya akan saya berikan pada postingan tersendiri nantinya. Baca juga : Contoh soal kali ini adalah untuk semakin membuat anda paham tentang asam basa.
Terdiri dari 5 soal umum, yang mana bisa anda jawab kalau anda sudah paham tentang prinsip-prinsip tentang asam basa.
Silakan kerjakan soal berikut :
1. Lihat reaksi di bawah ini, tentukan yang mana yang merupakan asam konjugasi 2. Senyawa yang mendonorkan proton adalah
3. Yang bukan senyawa amfoter
4. Yang merupakan asam Lewis adalah
a. memiliki pH kurang dari 7
b. bersifat korosif pada logam
c. merubah warna kertas lakmus merah menjadi biru
d. dapat menghantarkan listrik
1. H30+(aq), karena merupakan hasil reaksi yang memiliki kemampuan untuk mendonorkan proton. Lihat lagi materi tentang asam konjugasi pada teori Bronsted-Lowry
3. c. amonia, amonia merupakan senyawa yang bersifat basa.
4. a dan b, kedua senyawa tersebut dapat menerima pasangan elektron. Pada senyawa c sukar bereaksi dan dianggap bukan merupakan asam maupun basa, sedangkan d merupakan basa lewis karena dapat mendonorkan pasangan elektron
5. c, karena asam tidak merubah warna kertas lakmus merah menjadi biru. Warna kertas lakmus merah jika terkena asam akan tetap merah, atau justru semakin merah.
Gallery Pengertian Asam Dan Basa
 Klasifikasi Zat Asam Basa
Klasifikasi Zat Asam Basa
 Remedial Kimia Bab Larutan Asam Dan Basa
Remedial Kimia Bab Larutan Asam Dan Basa
 Teori Asam Basa Pengertian Sifat Teori Ahli Dosenpintar Com
Teori Asam Basa Pengertian Sifat Teori Ahli Dosenpintar Com
 Teori Asam Dan Basa Arrhenius Anggi Kimia Pasca Unp
Teori Asam Dan Basa Arrhenius Anggi Kimia Pasca Unp
 Indikator Asam Basa Pengertian Teori Dan Contohnya
Indikator Asam Basa Pengertian Teori Dan Contohnya
 Pengertian Asam Basa Dan Garam
Pengertian Asam Basa Dan Garam
 Materi Asam Dan Basa
Materi Asam Dan Basa
 Teori Asam Basa Arrhenius Bronsted Lowry Lewis Contoh
Teori Asam Basa Arrhenius Bronsted Lowry Lewis Contoh
 Soal Kimia Kelas Xi Pengertian Dan Teori Asam Basa Kimia
Soal Kimia Kelas Xi Pengertian Dan Teori Asam Basa Kimia
 Asam Basa Pengertian Teori Derajat Keasaman Ph Dan
Asam Basa Pengertian Teori Derajat Keasaman Ph Dan
 Media Pembelajaran Kimia By Dewi Wahyuningsih On Prezi
Media Pembelajaran Kimia By Dewi Wahyuningsih On Prezi
 Pengertian Sifat Sifat Dan Contoh Asam Basa Dan Garam
Pengertian Sifat Sifat Dan Contoh Asam Basa Dan Garam
 Pengertian Titrasi Asam Basa Auto Electrical Wiring Diagram
Pengertian Titrasi Asam Basa Auto Electrical Wiring Diagram
 Asam Basa Dan Garamxfdf
Asam Basa Dan Garamxfdf
 Kuliah 9 10 Teori Asam Basa Dan Perhitungan Ph
Kuliah 9 10 Teori Asam Basa Dan Perhitungan Ph
 Titrasi Asam Basa Pengertian Contoh Dan Titiknya
Titrasi Asam Basa Pengertian Contoh Dan Titiknya
 Asam Basa Garam Pengertian Sifat Ciri Macam
Asam Basa Garam Pengertian Sifat Ciri Macam
 Pengertian Sifat Dan Teori Asam Basa Dalam Kimia
Pengertian Sifat Dan Teori Asam Basa Dalam Kimia
 Makalah Hasil Pengamatan Asam Basa Docx Pengujian Larutan
Makalah Hasil Pengamatan Asam Basa Docx Pengujian Larutan
 Rpp Asam Basa Dan Stoikiometri Larutan 1
Rpp Asam Basa Dan Stoikiometri Larutan 1
 Larutan Asam Basa Mudah Mencari Dengan Berbagi
Larutan Asam Basa Mudah Mencari Dengan Berbagi
 Larutan Asam Pengertian Ciri Sifat Hujan Contohnya
Larutan Asam Pengertian Ciri Sifat Hujan Contohnya
 Asam Basa Bronsted Lowry Lewis Kimia Kelas Xi
Asam Basa Bronsted Lowry Lewis Kimia Kelas Xi
 Pengertian Larutan Asam Basa Contoh Serta Indikator Asam
Pengertian Larutan Asam Basa Contoh Serta Indikator Asam 
 Remedial Kimia Bab Larutan Asam Dan Basa
Remedial Kimia Bab Larutan Asam Dan Basa  Teori Asam Basa Pengertian Sifat Teori Ahli Dosenpintar Com
Teori Asam Basa Pengertian Sifat Teori Ahli Dosenpintar Com  Teori Asam Dan Basa Arrhenius Anggi Kimia Pasca Unp
Teori Asam Dan Basa Arrhenius Anggi Kimia Pasca Unp  Indikator Asam Basa Pengertian Teori Dan Contohnya
Indikator Asam Basa Pengertian Teori Dan Contohnya  Pengertian Asam Basa Dan Garam
Pengertian Asam Basa Dan Garam  Teori Asam Basa Arrhenius Bronsted Lowry Lewis Contoh
Teori Asam Basa Arrhenius Bronsted Lowry Lewis Contoh  Soal Kimia Kelas Xi Pengertian Dan Teori Asam Basa Kimia
Soal Kimia Kelas Xi Pengertian Dan Teori Asam Basa Kimia  Asam Basa Pengertian Teori Derajat Keasaman Ph Dan
Asam Basa Pengertian Teori Derajat Keasaman Ph Dan  Media Pembelajaran Kimia By Dewi Wahyuningsih On Prezi
Media Pembelajaran Kimia By Dewi Wahyuningsih On Prezi  Pengertian Sifat Sifat Dan Contoh Asam Basa Dan Garam
Pengertian Sifat Sifat Dan Contoh Asam Basa Dan Garam  Pengertian Titrasi Asam Basa Auto Electrical Wiring Diagram
Pengertian Titrasi Asam Basa Auto Electrical Wiring Diagram  Kuliah 9 10 Teori Asam Basa Dan Perhitungan Ph
Kuliah 9 10 Teori Asam Basa Dan Perhitungan Ph  Titrasi Asam Basa Pengertian Contoh Dan Titiknya
Titrasi Asam Basa Pengertian Contoh Dan Titiknya  Asam Basa Garam Pengertian Sifat Ciri Macam
Asam Basa Garam Pengertian Sifat Ciri Macam  Pengertian Sifat Dan Teori Asam Basa Dalam Kimia
Pengertian Sifat Dan Teori Asam Basa Dalam Kimia  Makalah Hasil Pengamatan Asam Basa Docx Pengujian Larutan
Makalah Hasil Pengamatan Asam Basa Docx Pengujian Larutan  Rpp Asam Basa Dan Stoikiometri Larutan 1
Rpp Asam Basa Dan Stoikiometri Larutan 1  Larutan Asam Basa Mudah Mencari Dengan Berbagi
Larutan Asam Basa Mudah Mencari Dengan Berbagi  Larutan Asam Pengertian Ciri Sifat Hujan Contohnya
Larutan Asam Pengertian Ciri Sifat Hujan Contohnya  Asam Basa Bronsted Lowry Lewis Kimia Kelas Xi
Asam Basa Bronsted Lowry Lewis Kimia Kelas Xi 


0 Response to "Pengertian Asam Dan Basa"
Post a Comment