Unsur Logam Dan Non Logam
 Ipa Terpadu Materi Dan Perubahannya Ppt Download
Ipa Terpadu Materi Dan Perubahannya Ppt Download
Materi Lengkap Kimia Non Logam
Ingat kembali bahwa kita dapat mengelompokkan unsur-unsur kedalam logam, metaloid dan non logam. Kecuali hidrogen, yang merupakan kasus spesial, non logam menempati bagian kanan atas tabel periodik. Seperti yang terlihat pada Gambar 7.1, terdapat suatu kecenderungan sifat-sifat unsur dalam tabel periodik. Keelektronegatifan, sebagai contoh, semakin besar dari kiri ke kanan dalam satu periode dan berkurang dari atas kebawah dalam satu golongan. Non logam memiliki keelektronegatifan lebih besar dibandingkan logam. Perbedaan ini mengakibatkan pembentukan padatan ionik pada reaksi antara logam dan non logam. Sebaliknya senyawa yang dibentuk antara non logam merupakan senyawa molekular dan tidak jarang merupakan gas, cairan atau padatan yang mudah menguap (volatile) pada suhu kamar.
Di antara non logam, kimiawi yang dimiliki oleh anggota pertama suatu golongan dapat berbeda dalam beberapa cara yang penting dari anggota lainnya. Sebagai contoh, non logam pada periode tiga dan periode-periode selanjutnya dapat mengakomodasi ikatan yang lebih luas dengan atom tetangga. Perbedaan penting lainnya adalah unsur pertama setiap golongan dapat dengan mudah membentuk ikatan phi (π) dibandingkan unsur-unsur dibawahnya. Kecenderungan ini terutama disebabkan oleh ukuran atom. Atom-atom yang lebih kecil dapat mendekat satu sama lain lebih rapat. Sebagai hasilnya, tumpang tindih sisi orbital p (pembentukan ikatan phi) lebih efektif untuk anggota pertama setiap golongan (Gambar 7.2). Tumpang tindih yang lebih efektif berarti ikatan phi yang lebih kuat, yang tercermin dalam entalpi ikatan rangkap yang dimilikinya. Sebagai contoh, perbedaan entalpi ikatan C-C dan C=C adalah 270 kJ/mol; nilai ini mencerminkan kekuatan ikatan phi karbon-karbon. Apabila dibandingkan, kekuatan ikatan phi silikon-silikon hanya 100kJ/mol, yang tentu saja lebih rendah dibandingkan ikatan phi karbon. Seperti yang akan kita lihat, ikatan phi sangat penting pada kimiawi karbon, nitrogen dan oksigen, yang lebih sering membentuk ikatan ganda. Unsur-unsur pada periode 3, 4, 5, dan 6 hanya memiliki kecenderungan untuk membentuk ikatan tunggal.
Kemudahan unsur-unsur periode dua untuk membentuk ikatan phi merupakan faktor penting dalam menentukan struktur unsur tersebut dan senyawa-senyawanya. Sebagai contoh marilah kita bandingkan bentuk elemental dari karbon dan silikon. Karbon memiliki empat allotropi kristal yaitu intan, grafit, fullerene dan carbon nano tube. Intan merupakan jaringan kovalen padat yang memiliki ikatan sigma (σ) C-C tanpa ada ikatan phi. Grafit, fullerene dan carbon nano tube memiliki ikatan phi, yang dihasilkan dari tumpang tindih sisi-sisi orbital p. Silikon berada hanya sebagai jaringan kovalen padat seperti intan dengan ikatan sigma. Silikon tidak memiliki bentuk yang mirip struktur grafit, fullerene dan carbon nano tube karena ikatan phi Si-Si sangat lemah. Demikian pula dengan perbedaan yang signifikan antara dioksida karbon dan silikon (Gambar 7.3). CO2 merupakan senyawa molekular dengan ikatan rangkap C-O, sedangkan SiO2 tidak memiliki ikatan rangkap. SiO2 merupakan jaringan kovalen padat dimana empat atom oksigen terikat dengan setiap atom silikon melalui suatu ikatan tunggal, membentuk suatu struktur yang tak terbatas dengan rumus empiris SiO2
1. HIDROGEN
Ahli kimia Inggris, Henry Cavendish (1731-1810) merupakan orang yang pertama kali mengisolasi hidrogen murni. Karena unsur tersebut menghasilkan air jika dibakar diudara, ahli kimia Francis, Lavoisier menamakannya “hydrogen”, yang berarti “ penghasil air” (bahasa latin : hydro= air, gennao = penghasil).
Hidrogen merupakan unsur paling melimpah di alam semesta. Hidrogen merupakan bahanbakar nuklir yang digunakan matahari dan bintang-bintang lainnya untuk menghasilkan energi.Meskipun hampir 75% massa alam semesta tersusun oleh hidrogen, namun hidrogen hanyamenyusun 0,87% massa bumi. Hampir semua hidrogen di bumi ditemukan bersenyawa denganoksigen. Air, dengan 11% massa hidrogen, merupakan senyawa hidrogen yang paling melimpah.
Isotop Hidrogen
Isotop hidrogen yang paling umum, 11 H, memiliki inti yang terdiri dari satu proton. Isotopini terkadang disebut sebagai protium, menyusun 99,9844% hidrogen yang ada di alam. Duaisotop lainnya adalah 21 H (inti tersusun dari satu proton dan satu netron) dan 31 H (inti tersusun dari satu proton dan dua netron), Gambar 7.4. isotop 21 H, disebut deuterium, menyusun0,0156% hidrogen di alam. Deuteium tidak bersifat radioaktif. Deuterium diberi simbol D dalamsuatu rumus kimia, seperti pada D 2 O (deuterium oksida atau heavy water).
Isotop ketiga adalah tritium, 31 H, yang bersifat radioaktif dengan waktu paruh 12,3 tahun.
31 H → 32 He + 0-1 e t 1/2 = 12,3 tahun
Karena waktu paruhnya yang pendek, hanya sedikit tritium ada di alam. Isotop tritium dapat disintesa dalam reaktor nuklir dengan memborbardir litium-6 dengan neutron.
63 Li + 10 n → 3 1 H + 42 He
Deuterium dan tritium telah terbukti bernilai dalam mempelajari reaksi senyawa yang mengandung hidrogen. Suatu senyawa dapat “dilabeli” dengan mengganti satu atau lebih atom hidrogen biasa pada lokasi tertentu dalam molekul dengan deuterium atau tritium. Dengan membandingkan lokasi label dalam reaktan dan produk reaksi, mekanisme reaksi dapat disimpulkan. Apabila metanol (CH3 OH) dilarutkan dalam D2O, atom H pada ikatan O-H mengalami pergantian sangat cepat dengan atom D dari D2O, membentuk CH3 OD. Atom H pada gugus CH3 tidak mengalami pergantian. Eksperimen ini menunjukkan kestabilan kinetik ikatan C-H dan mengungkapkan kecepatan ikatan O-H diputuskan dan dibentuk kembali.
Sifat-Sifat Hidrogen
Hidrogen merupakan satu-satunya unsur yang tidak termasuk kedalam golongan apapun dalam sistem periodik. Karena konfigurasi elektronnya 1s1 , hidrogen ditempatkan diatas litium dalam sistem periodik. Namun pada dasarnya hidrogen bukan logam alkali tanah. Hidrogen lebih sukar membentuk ion positif jika dibandingkan logam alkali. Energi ionisasi atom hidrogen adalah 1312 kJ/mol sedangkan litium 520 kJ/mol.
Hidrogen terkadang ditempatkan diatas halogen pada sistem periodik karena atom hidrogen dapat menangkap satu elektron membentuk ion hidrida, H – , yang memiliki konfigurasi elektron yang sama seperti helium. Afinitas elektron hidrogen, -73 kJ/mol, tidak sebesar halogen. Afinitas elektron fluorin adalah -328 kJ/mol dan iodin -295 kJ/mol. Secara keseluruhan hidrogen lebih menunjukkan kemiripan pada alkali dibandingkan halogen.
Bentuk elemental hidrogen hadir pada suhu kamar sebagai molekul gas diatomik yang tidak berwarna, tidak berbau dan tidak berasa. Kita dapat menyebut H2 sebagai dihidrogen, tetapi lebih sering dikenal sebagai molekul hidrogen atau secara sederhana hidrogen saja. Gaya tarik antar molekul H2 sangat lemah karena H2 non polar dan hanya memiliki dua elektron. Akibatnya, titik leleh dan titik didihnya sangat rendah, berturut-turut -259 0C dan -253 0C.
Entalpi ikatan H-H sangat tinggi untuk suatu ikatan tunggal, 436 kJ/mol. Bandingkan dengan entalpi ikatan Cl-Cl yang hanya 242 kJ/mol. Karena H2 memiliki ikatan yang sangat kuat, kebanyakan reaksi H2 sangat lambat pada suhu kamar. Namun, molekul H2 sangat mudah diaktivasi oleh panas, radiasi atau katalis. Proses aktivasi menghasilkan atom hidrogen yang sangat reaktif. Sesaat setelah H2 diaktivasi, reaksi berlangsung cepat dan sangat eksotermis.
Hidrogen membentuk ikatan kovalen yang kuat dengan unsur-unsur lain, termasuk oksigen, entalpi ikatan O-H adalah 463 kJ/mol. Pembentukan ikatan O-H yang kuat menjadikan hidrogen reduktor yang efektif untuk merduksi oksida logam. Apabila H 2 dilewatkan kedalam CuO panas, akan dihasilkan Cu.
CuO (s) + H 2 (g) → Cu (s) + H 2 O (g)
Apabila H2 dibakar diudara, terjadi reaksi yang sangat hebat, membentuk H2O. Udara yang mengandung sedikitnya 4% volume H2 berpotensi eksplosif. Pembakaran campuran oksigen-hidrogen umumnya digunakan sebagai bahan bakar cair roket pesawat ruang angkasa. Hidrogen dan oksigen disimpan pada suhu rendah dalam bentuk cair.
Pembuatan Hidrogen
Apabila sejumlah kecil H2 diperlukan di laboratorium, hidrogen biasanya diperoleh dengan mereaksikan logam aktif, seperti Zn dengan asam kuat seperti HCl dan H2SO4 .
Zn (s) + 2H + (aq) → Zn2+ (aq) + H2 (g)
Sejumlah besar H2 diproduksi dengan mereaksikan metana, CH4 dengan uap air pada 1110 0 C.
CH4 (g) + H2O (g) → CO (g) + 3 H2 (g) CO (g) + H2O (g) → CO2 (g) + H2 (g)
Apabila dipanaskan pada suhu 1000 0 C, karbon juga bereaksi dengan uap menghasilkan campuran gas CO dan H 2 .
C (s) + H2O (g) → H2 (g) + CO (g) Campuran ini disebut ‘water gas’, yang digunakan pada industri bahan bakar. Elektrolisis air memerlukan banyak energi sehingga terlalu mahal untuk memproduksi H 2 secara komersial. Namun, H 2 diproduksi sebagai by-produk pada elektrolisis air asin (NaCl) pada
produksi Cl 2 dan NaOH.
2 NaCl (aq) + 2 H2O (l) → H 2 (g) + Cl2 (g) + 2 NaOH (aq)
Hidrogen digunakan dalam sintesis amonia melalui proses Haber. Hidrogen juga digunakan dalam pembuatan metanol melalui reaksi katalitik CO dan H 2 pada tekanan dan suhu tinggi.
CO (g) + 2H2 (g) → CH3OH (g)
Senyawa Biner Hidrogen
Hidrogen bereaksi dengan unsur lainnya membentuk senyawa dengan tipe: hidrida ionik, hidrida metalik, dan hidrida molekular. Hidrida ionik dibentuk apabila hidrogen bereaksi dengan logam alkali dan alkali tanah yang lebih besar (Ca, Sr dan Ba). Logam aktif ini kurang elektronegatif dibandingkan hidrogen, sehingga hidroegn akan menangkap elektron dari logam tersebut membentuk ion hidrida, H – .
Ca (s) + H2 (g) → CaH2 (s)
Ion hidrida merupakan basa kuat dan sangat mudah bereaksi bahkan dengan asam donor proton yang sangat lemah sekalipun, membentuk H 2 . Contoh, H – mudah bereaksi dengan air.
H- (aq) + H2O (l) → H2 (g) + OH – (aq)
Hidrida ionik dapat digunakan sebagai sumber H 2 meskipun sangat mahal. Kalsium hidrida, CaH2 , dijual secara komersial dan digunakan untuk memompa balon udara (balon cuaca).
Hidrida metalik dibentuk apabila hidrogen bereaksi dengan logam-logam transisi. Senyawa ini disebut demikian karena tetap mempertahankan sifat konduktivitas dan sifat logam lainnya. Dalam hidrida metalik, rasio atom logam terhadap atom hidrogen tidak tentu atau merupakan bilangan bulat kecil. Komposisi bervariasi, tergantung pada kondisi sintesis. TiH2 dapat dihasilkan, tetapi pembuatannya biasanya menghasilkan TiH1,8 , yang kekurangan 10% hidrogen dibandingkan TiH2 . Hidrida metalik yang nonstoikiometrik tersebut terkadang disebut hidrida interstitial.
Hidrida molekular, dibentuk melalui reaksi dengan nonlogam atau semilogam, merupakan gas atau cairan pada kondisi standar. Hidrida molekul sederhana dirangkumkan dalam Gambar 7.6, bersama dengan energi bebas pembentukannya, Δ 0 G f .
3. GOLONGAN VIIIA: GAS MULIA
Unsur-unsur golongan VIIIA adalah unsur yang tidak reaktif. Kebanyakan referensi mengenai unsur-unsur tersebut berkaitan dengan sifat fisika yang dimilikinya, terutama gaya intermolekular. Sifat inert yang dimiliki unsur-unsur golongan VIII A disebabkan keadaan elektron kulit valensi yang oktet (kecuali He, 2 elektron). Kestabilan seperti ini tercermin dari tingginnya energi ionisasi yang dimilikinya.
Unsur-unsur golongan VIIIA berada dalam bentuk gas pada suhu kamar. Semuanya merupakan komponen atmosfer bumi, kecuali radon, yang memiliki waktu hidup singkat sebagai radioisotop. Hanya argon yang relatif tersedia melimpah. Neon, argon, kripton dan xenon diperoleh dari udara cair dengan destilasi. Argon digunakan sebagai lapisan atmosfer pada lampu pijar. Gas menghantarkan panas keluar filamen tetapi tidak bereaksi dengannya. Argon juga digunakan sebagai atmosfer pelindung untuk mencegah oksidasi pada proses pengelasan dan proses metalurgi tertentu yang melibatkan suhu tinggi.
Helium merupakan gas mulia yang paling penting. Helium cair digunakan sebagai pendingin pada eksperimen yang dilakukan pada suhu sangat rendah. Helium mendidih pada 4,2 K tekanan 1 atm, titik didih terendah dari zat yang ada. Helium juga ditemukan dengan konsentrasi yang relatif tinggi dalam gas alam. Terkadang helium dipisahkan untuk kepentingan permintaan, namun terkadang tetap berada dalam gas alam untuk keperluan lebih lanjut.
Senyawa-senyawa Gas Mulia
Karena gas mulia sangat stabil, mereka hanya mengalami reaksi kimia pada kondisi yang sangat tepat dan ekstrim. Kita dapat mengharapkan gas mulia lebih berat lebih mudah membentuk senyawa karena energi ionisasi yang lebih rendah dibandingkan gas mulia yang lebih ringan. Ionisasi yang rendah mengisyaratkan kemungkinan pemakaian bersama (sharing) elektron dengan atom lain membentuk suatu ikatan kimia. Karena unsur-unsur gas mulia (kecuali He) memiliki 8 elektron valensi, pembentukan ikatan kovalen menggunakan kulit valensi yang diperluas. Kulit valensi yang diperluas berlangsung lebih mudah pada atom-atom berukuran besar.
Senyawa gas mulia pertama kali dilaporkan pada 1962. Penemuan ini menimbulkan sensasi karena mematahkan kepercayaan bahwa gas mulia benar-benar inert. Studi awal melibatkan xenon yang berkombinasi dengan fluorin, Xenon merupakan unsur yang diharapkan paling reaktif diantara gas mulia lainnya. Sejak saat itu, ahli kimia berhasil mensintesa senyawa xenon dengan fluorin dan oksigen. Beberapa sifat senyawa tersebut diringkaskan dalam Tabel 1. Ketiga fluorida (XeF2, XeF4, XeF6) dibuat dengan reaksi langsng xenon dan fluorin. Dengan memvariasikan rasio reaktan dan kondisi reaksi, salah satu dari senyawa tersebut dapat diperoleh. Senyawa yang mengandung oksigen dihasilkan ketika fluorida direaksikan dengan air :
XeF 6 (s) + 3 H 2 O (l) → XeO 3 (aq) + 6 HF (aq)
Unsur-unsur gas mulia lainnya lebih sulit membentuk senyawa dibandingkan xenon. Selama bertahun-tahun hanya dikenal satu senyawa biner kripton, KrF 2 , yang mudah terdekomposisi menjadi unsur-unsurnya pada -10 0 C. Senyawa kripton yang lain telah berhasil diisolasi pada suhu yang sangat rendah (40 K).
4. GOLONGAN VIIA: HALOGEN
Unsur-unsur golongan VIIA memiliki konfigurasi elektron kulit terluar ns 2 np 5 , dimana n dapat bernilai dari 2 sampai 6. Halogen memiliki afinitas elektron yang sangat negatif dan paling sering mencapai konfigurasi gas mulia dengan cara mendapatkan satu elektron membentuk keadaan oksidasi -1. Fluorin merupakan unsur paling elektronegatif, berada dalam senyawanya hanya dalam bentuk oksidasi -1. Halogen lainnya memiliki keadaan oksidasi positif hingga +7 dalam senyawa yang mengandung atom yang lebih elektronegatif seperti O. Dalam keadaan oksidasi positif, halogen merupakan oksidator yang baik, mudah menerima elektron.
Klorin, bromin, dan iodin ditemukan sebagai halida dalam air laut dan deposit garam. Fluorin ditemukan dalam mineral Fluorspar (CaF 2 ), kriolit (Na 3 AlF 6 ) dan fluoroapatit [Ca 5 (PO 4 ) 3 F]. Hanya fluorspar yang merupakan sumber fluor yang penting secara komersial. Semua isotop astatin merupakan radioisotop, Waktu hidup isotop terlama adalah astatin-210, dengan waktu paruh 8,1 jam dan meluruh denga cara menangkap elektron. Karena astatin sangat tidak stabil dan mengalami peluruhan inti, sangat sedikit sifat kimianya yang diketahui.
Sifat Dan Preparasi Halogen
Beberapa sifat-sifat halogen dirangkumkan dalam Tabel 2. Pada kondisi biasa, halogen berada sebagai molekul diatomik. Dalam keadaan padat dan cair, molekul mengalami gaya dispersi London. Karena I 2 besar dan paling terpolarisasi diantara molekul diatomik halogen lainnya, gaya intermolekular diantara molekul I 2 merupakan yang paling kuat. Akibatnya, I 2 memiliki titik leleh dan titik didih tinggi. Pada suhu kamar dan tekanan 1 atm, I 2 berwujud padat, Br 2 cair, Cl 2 dan F 2 gas. Klorin dapat dengan mudah dicairkan dengan suatu kompresi pada suhu kamar dan disimpan dalam bentuk cair dalam suatu wadah baja.
Karena keelektronegatifan yang tinggi, halogen cenderung untuk menarik elektron dari zat lain dan oleh karenanya merupakan oksidator. Kemampuan okssdator halogen yang diindikasikan oleh potensial reduksinya, berkurang dari atas ke bawah. Hasilnya, halogen mampu mengoksidasi anion halogen yang terletak dibawahnya. Contoh, Cl 2 akan mengoksidasi Br – dan I – , tetapi tidak dapat mengoksidasi F – .
Seperti yang terlihat pada Tabel 2, potensial reduksi standar F 2 sangat tinggi. Gas fluorin dapat dengan mudah mengoksidasi molekul air. F 2 (aq) + H 2 O (l) → 2 HF (aq) + ½ O2 (g) E 0 = 1,80 V Fluorin tidak dapat dihasilkan dengan oksidasi elektrolisis larutan akua garam fluorida karena molekul air lebih mudah dioksidasi dibandingkan F – . Dalam prakteknya, F 2 dihasilkan dari oksidasi elektrolisis larutan KF dalam HF anhidrat.
Klorin dapat diproduksi dengan cara elektrolisis lelehan garam NaCl maupun larutan akua NaCl. Bromin dan iodin dapat diperoleh secara komersial melalui oksidasi dengan Cl 2 dari asin yang mengandung ion halida.
Kegunaan Halogen
Fluorin merupakan bahan kimia penting di industri. Fluorin digunakan untuk membuat fluorokarbon, suatu senyawa yang sangat stabil yang digunakan sebagai lubrikan, plastik dan pendingin pada lemari es. Teflon ® (Gambar 7.7) adalah polimer fluorokarbon yang dikenal karena stabilitas termalnya yang tinggi dan reaktivitas kimia yang rendah.
Klorin digunakan dalam produksi senyawa organik yang mengandung klor,seperti vinil klorida (C 2 H 3 Cl), yang digunakan dalam pembuatan plastik polivinil klorida (PVC). Apabila Cl2 dilarutkan dalam larutan basa dingin, terjadi reaksi disproporsionasi menjadi Cl – dan hipoklorit (ClO – ).
Cl 2 (aq) + 2 OH – (aq) → Cl – (aq) + ClO – (aq) + H 2 O (l)
Natrium hipklorit (NaClO) merupakan bahan aktif dalam cairan pemutih. Klorin juga digunakan dalam pengolahan air untuk mengoksidasi dan membunuh bakteri.
Iodin umumnya digunakan sebagai KI dalam garam meja. Garam yang teriodisasi menyediakan sejumlah kecil iodin yang dibutuhkan tubuh untuk pembentukan tiroksin, hormon yang dikeluarkan oleh kelenjar tiroid. Kekurangan iodin akan menyebabkan pembesaran kelenjar tiroid yang disebut gondok (goiter).
Hidrogen Halida (asam halida)
Semua halogen membentuk senyawa diatomik stabil dengan hidrogen. Larutan akua HCl, HBr, dan HI merupakan asam kuat. Hidrogen halida dapat dibuat melalui reaksi langsung unsurnya. Namun, metode yang terpenting adalah dengan mereaksikan garam halida dengan asam kuat non volatil. HCl dan HF dibuat dengan cara ini.
CaF 2 (s) + H 2 SO 4 (l) → 2 HF (g) + CaSO 4 (s)
HBr dan HI tidak dapat dibuat dengan reaksi seperti diatas karena H 2 SO 4 mengoksidasi Br – dan I – Oksidasi yang tak diinginkan tersebut dapat dihindarkan dengan penggunaan H 3 PO 4 yang merupakan oksidator lebih lemah dibandingkan H 2 SO 4 . Asam fluorida mudah bereaksi dengan silika, SiO2 , membentuk asam heksafluorosilikat, H 2 SiF 6 .
SiO2 (s) + 6 HF (aq) → H 2 SiF 6 (aq) + 2 H 2 O (l)
Senyawa Antarhalogen
Selain molekul diatomik yang tersusun dari atom yang sama, terdapat pula senyawa diatomik yang tersusun oleh atom halogen yang berbeda. Senyawa-senyawa tersebut merupakan contoh paling sederhana senyawa yang disebut senyawa antarhalogen. Senyawa seperti ClF dan IF5 dibentuk dari dua unsur halogen yang berbeda.
Dengan satu pengecualian, senyawa antarhalogen besar dengan atom pusat Cl, Br dan I dikelilingi oleh 3, 5 atau 7 atom F. Ukuran atom iod yang besar mampu mengakomodasi pembentukan IF 3 , IF 5 dan IF 7 , dengan bilangan oksidasi I berturut-turut +3, +5 dan +7. Dengan atom brom dan klor yang lebih kecil, hanya senyawa dengan 3 dan 5 atom fluor yang dibentuk. ICl 3 dan ICl 5 merupakan satu-satunya senyawa antarhalogen besar yang mengandung bukan atom F, atom I yang besar mampu mengakomodasi 5 atom Cl, sedangkan Br tidak cukup besar bahkan untuk membentuk BrCl 3 . Semua senyawa antarhalogen merupakan oksidator kuat.
Asam Oksi dan Anion Oksi
Tabel 3 merangkumkan rumus asam oksi halogen. Kekuatan asam oksi meningkat seiring naiknya bilangan oksidasi atom pusat halogen. Semua asam oksi merupakan oksidator kuat. Anion oksi ,dihasilkan melalui pelepasan H + dari asam oksi, umumnya lebih stabil dibandingkan asam oksi. Garam hipoklorit digunakan sebagai pemutih dan disinfektan karena sifat oksidaot kuat ion ClO – . Natrium klorit juga digunakan sebagai agen pemutih. Garam klorat juga sangat reaktif. Sebagai contoh, Kalium klorat digunakan untuk membentuk korek api dan kembang api.
Asam perklorat dan garamnya merupakan asam oksi dan anion oksi yang paling stabil. Larutan asam perklorat sedikit lebih aman dan kebanyakan garam perklorat stabil kecuali jika dipanaskan dengan material organik. Apabila dipanaskan, perklorat merupakan pengoksidasi yang sangat hebat. Sangat diperlukan kehati-hatian dalam menangani perklorat dan sangat penting untuk menghindari kontak antara perklorat dengan senyawa organik yang mudah terbakar. Penggunaan amonium perklorat (NH 4 ClO 4 ) sebagai oksidator pada pendorong roket pesawat ruang angkasa mencontohkan kekuatan oksidasi perklorat. Bahan bakar padat
merupakan campuran antara NH 4 ClO 4 dan bubuk aluminium, suatu reduktor. Setiap kali peluncuran pesawat ruang angkasa membutuhkan 700 ton NH 4 ClO 4 .
5. OKSIGEN
Pada pertengahan abad ke 17, ilmuwan telah mengenali bahwa udara mengandung suatu komponen yang berperan dalam pembakaran dan pernafasan. Komponen tersebut tidak diisolasi sampai 1774, ketika Joseph Priestley menemukan oksigen. Lavoiser menamakan unsur tersebut oksigen yang artinya “pembentuk asam”.
Oksigen ditemukan berkombinasi dengan unsur lainnya dalam senyawa yang beraneka ragam. Oksigen merupakan komponen paling melimpah berdasarkan massa di kerak bumi maupun tubuh manusia. Oksigen merupakan oksidator pada proses metabolisme dan sangat penting dalam kehidupan manusia.
Sifat-sifat Oksigen
Oksigen mempunyai dua allotropi, O2 dan O3 . Apabila kita membicarakan oksigen molekul atau oksigen, biasanya telah dipahami bahwa yang dimaksud adalah dioksigen (O2 ). O 3 disebut ozon.
Pada suhu kamar, dioksigen merupakan gas yang tidak berwarna dan tidak berbau. Oksigen terkondensasi menjadi cair pada -183 0 C dan membeku pada -218 0 C. Oksigen sedikit larut dalam air (0,04 g/L atau 0,001 M pada 25 0 C), tetapi keberadaannya dalam air sangat penting bagi kehidupan di perairan laut.
Konfigurasi elektron atom oksigen adalah [He]2s 2 sp 4 . Jadi, oksigen melengkapi konfigurasi menjadi oktet dengan menangkap dua elektron membentuk ion oksida, O2- atau pemakaian bersama dua elektron. Dalam senyawa kovalennya, oksigen cenderung membentuk dua ikatan, baik itu sebagai dua ikatan tunggal seperti dalam H 2 O atau sebagai suatu ikatan rangkap 2 seperti dalam formaldehid (H 2 C=O). Ikatan rangkap dua juga terdapat dalam molekul O2 . Ikatan dalam O2 sangat kuat (entalpi ikatan = 495 kJ/mol). Oksigen juga membentuka ikatan sangan kuat dengan kebanyakan unsur lain. Konsekuensinya, kebanyakan unsur yang mengandung oksigen secara termodinamika lebih stabil daripada O2 . Tanpa adanya katalis, reaksi-reaksi O2 memiliki energi aktivasi tinggi sehingga memerlukan suhu tinggi supaya berlangsung dengan laju yang berarti. Sesaat reaksi eksotermik dimulai, terjadi akselerasi yang
sangat cepat, menghasilkan reaksi yang sangat eksplosif.
Pembuatan Oksigen
Hampir semua oksigen diperoleh secara komersial dari udara. Titik didih normal O2 adalah -183 0 C, sedangkan N 2 yang merupakan komponen utama udara mendidih pada -196 0 C. Jadi ketika udara dicairkan dan kemudian dipanaskan, N 2 akan mendidih, sementara O2 tetap cair dengan sedikit pengotor N 2 dan Ar. Dalam laboratorium, O2 diperoleh dengan memanaskan lautan akua hidogen peroksida maupun padatan kalium klorat (KClO 3 ). 2 KClO 3 (s) → 2 KCl (s) + 3 O2 (g) Kedua reaksi tersebut dikatalis oleh mangan dioksida (MnO2 ).
O2 di atmosfer dihasilkan melalui proses fotosintesis, yaitu proses dimana tumbuhan menggunakan energi matahari untuk menghasilkan O2 dari CO2 .
Kegunaan Oksigen
Oksigen merupakan salah satu bahan kimia industri yang paling banyak digunakan setelah asam sulfat (H 2 SO 4 ) dan nitrogen (N2). Oksigen sejauh ini merupakan oksidator yang paling luas digunakan. Hampir setengah dari O2 yang diproduksi digunakan di industri baja, terutama untuk menghilangkan pengotor dari baja. Oksigen juga digunakan sebagai pemutih pulp dan kertas. Di bidang kesehatan digunakan untuk meringankan kesulitan pernafasan. Oksigen juga digunakan bersama asetelina pada proses pengelasan. Reaksi antara C2H2 dan O2 sangat eksotermik, menghasilkan kenaikan temperatur hingga melebihi 3000 0 C.
2 C2H2 (g) + 5 O2 (g) → 4 CO2 (g) + 2 2O (g) ΔH0 = -2510 kJ
Ozon
Struktur ozon diperlihatkan pada Gambar 7.8. Molekul memiliki suatu ikatan phi yang terdelokalisasi pada tiga atom oksigen. Ozon mudah mengalami disosiasi membentuk atom oksigen yang reaktif.
O3 (g) → O2 (g) + O(g) ΔH0 = 105 kJ
Ozon merupakan oksidator lebih kuat dibandingkan dioksigen. Ozon membentuk oksida dengan sejumlah unsur pada kondisi dimana oksigen tidak bereaksi. Ozon mengoksidasi semua logam kecuali emas dan platina. Ozon dapat dibuat dengan mengalirkan listrik melalui O 2 kering dalam suatu pipa alir. Muatan listrik menyebabkan ikatan O 2 putus, sehingga terjadi reaksi : 3O2 (g) → 2O3 (g) ΔH0 = 285 kJ
Ozon tidak dapat disimpan dalam waktu yang lama karena mudah terdekomposisi menjadi O2 , kecuali pada suhu rendah. dekomposisi dikatalis oleh logam-logam tertentu seperti Ag, Pt, dan Pd serta sejumlah oksida logam transisi.
Ozon merupakan komponen penting pada lapisan atas atmosfer karena ozon mampu menyaring sinar ultraviolet. Dengan cara ini, ozon melindungi bumi dari efek radiasi berenergi tinggi. Karena alasan inilah penipisan lapisan ozon di stratorfer menjadi perhatian utama dibidang ilmiah. Pada bagian bawah atmosfer, ozon merupakan suatu polutan udara, karena merupakan komponen utama smog. Karena kemampuan oksidasinya, ozon dapat menghancurkan sistem kehidupan dan material struktural, terutama karet.
Oksida
Oksigen memiliki kelektronegatifan nomor dua setelah fluorin. Hasilnya, oksigen memiliki bilangan oksidasi negatif dalam semua senyawanya kecuali dengan fluorin, OF2 dan O2F2 . Bilangan oksidasi -2 merupakan yang paling umum. Senyawa dengan bilangan oksidasi -2 disebut oksida.
Non logam membentuk oksida kovalen. Kebanyakan oksida terebut adalah molekul sederhana dengan titik leleh dan titik didih rendah. SiO2 dan B2O3 memiliki struktur polimer. Oksida non logam berkombinasi dengan air membentuk asam oksi. Contoh, belerang dioksida dilarutkan dalam air menghasilkan asam sulfit.
SO2 (g) + H2O (l) → H2SO3 (aq)
Reaksi yang mirip terjadi pada SO 3 membentuk H2SO4 , CO2 membentuk asam karbonat, H2CO3 . Oksida yang bereaksi dengan air membentuk asam disebut anhidrida asam atau oksida asam. Beberapa oksida non logam terutama oksida dengan non logam dalam keadaan oksidasi
rendah, seperti N2O, NO dan CO tidak bereaksi dengan air sehingga bukanlah anhidrida asam.
Oksida logam bersifat ionik. Oksida ionik yang dilarutkan dalam air dan membentuk hidroksida disebut anhidrida basa atau oksida basa. Barium oksida (BaO) bereaksi dengan air membentuk barium hidroksida [Ba(OH) 2 ]. Jenis reaksi seperti ini terjadi dikarenakan sifat ion O2- yang sangat basa dan mengalami hidrolisis virtual sempurna dalam air.
O2- (aq) + H2O (l) → 2OH – (aq)
Oksida ionik yang tidak larut dalam air mudah larut dalam asam kuat. Contohnya Besi (III) oksida mudah larut dalam asam:
Fe2O3 (s) + 6H + (aq) → 2 Fe3+ (aq) + 3H2O (l)
Reaksi ini digunakan untuk menghilangkan karat (Fe 2 O 3 .nH 2 O) pada besi atau baja sebelum dilindungi dengan pelapisan seng atau timah. Oksida yang memiliki sifat asam maupun basa disebut amfoter. Jika suatu logam membentuk lebih dari satu oksida, karakter basa dari oksida berkurang apabila bilangan oksidasi logam naik, seperti yang diilustrasikan dalam Tabel 4.
Peroksida dan Superoksida
Senyawa yang memiliki ikatan O-O dan oksigen berada dalam keadaan oksidasi -1 disebut peroksida. Oksigen yang memiliki bilangan oksidasi -1/2 dalam O2- disebut ion superoksida. Logam-logam paling aktif (K, Rb, dan Cs) bereaksi dengan O2 menghasilkan superoksida (KO2 , RbO2 dan CsO2 ), sementara dengan logam aktif didekatnya (Na, Ca, Sr dan Ba) bereaksi membentuk peroksida (Na2O2 , CaO2 , SrO2 dan BaO2 ). Logam yang kurang aktif menghasilkan oksida biasa. Apabila superoksida dilarutkan dalam air, dihasilkan O2 . 4 KO2 (s) + 2 H2O (l) → 4 K + (aq) + 4 OH – (aq) + 3 O2 (g) Hidrogen peroksida merupakan peroksida yang paling umum dan penting secara komersial. Struktur H2O2 diperlihatkan pada Gambar 7.9. Hidrogen peroksida pekat merupakan senyawa
yang berbahaya karena sangat reaktif, terdekomposisi secara eksotermik menghasilkan air dan gas oksigen.
2 H2O2 (l) → 2 H2O (l) + O2 (g) ΔH0 = -196,1 kJ
Reaksi tersebut merupakan reaksi disproporsionasi. Bilangan oksidasi oksigen berubah dari -1 menjadi -2 dan 0.
Hidrogen peroksida dijual sebagai pereaksi kimia dalam lautan akua hingga 30% massa. Larutan yang mengandung 3% massa H2O2 dijual ditoko obat dan digunakan sebagai antiseptik. Ion peroksida juga merupakan by-produk metabolisme yang dihasilkan dari reduksi O2 . Tubuh menghasilk spesi reaktif ini dengan bantuan enzim seperti peroksidase dan katalase.
6. UNSUR_UNSUR GOLONGAN VIA LAINNYA : S,Se, Te dan Po
Selain oksigen, anggota golongan VIA lainnya adalah belerang, selenium, tellurium, dan polonium. Dalam bagian ini kita akan membahas sifat golongan VIA secara keseluruhan dan membahas kimiawi belerang, selenium dan telurrium. Polonium akan dibahas secara singkat, karena tidak terdapat isotop polonium yang stabil. Polonium ditemukan hanya dalam jumlah sedikit dan sesaat dalam mineral yang mengandung radium.
Karakter umum Unsur golongan VIA
Unsur golongan VIA memiliki konfigurasi elektron terluar ns 2 np 4 , dengan n=2 sampai 6. Unsur golongan memperoleh konfigurasi elektron gas mulia dengan penambahan dua elektron, menghasilkan bilangan oksidasi -2. Kecuali oksigen, unsur golongan VIA juga ditemukan memiliki bilangan oksidasi positif dan dapat berikatan dengan menggunakan kulit valensi yang diperluas. Senyawa-senyawa seperti SF6 , SeF6 dan TeF6 memiliki bilangan oksidasi atom pusat +6. Tabel 5 merangkumkan beberapa sifat penting unsur-unsur golongan VIA.
Keberadaan dan Preparasi S, Se dan Te
Belerang ditemukan dalam sejumlah besar deposit ditanah. Belerang juga berada dalam bentuk mineral sulfida dan sulfat. Keberadaannya sebagai komponen minor dalam batubara dan minyak bumi menjadi masalah serius. Pembakaran bahan bakar yang mengandung belerang menghasilkan polutan oksida belerang. Selenium dan telurium ditemukan dalam mineral jarang seperti Cu2 Se, PbSe, Cu2Te, dan PbTe. Keduanya juga hadir sebagai komonen minor dalam bijih sulfida tembaga, besi, nikel dan timbal.
Sulfida
Belerang membentuk sejumlah senyawa dengan unsur lain. Apabila unsur tersebut kurang elektronegatif dibandingkan belerang, akan dihasilkan suatu sulfida, S2- . Besi (II) sulfida merupakan contoh sulifa yang dihasilkan dari kombinasi langsung besi dengan belerang. Unsur-unsur logam banyak ditemukan dalam bentuk bijih sulfidanya seperti galena (PbS) dan cinnabar (HgS). Suatu jenis bijih yang mengandung ion disulfida, S22- (mirip ion peroksida) juga dapat ditemukan yaitu pyrit. Besi pyrit, FeS 2 , memiliki kristal kubik berwana kuning emas. Karena pyrit sering membuat penambang emas keliru, maka pyrit disebut emas palsu. Salah satu sulfida terpenting adalah hidrogen sulfida (H 2 S). Senyawa ini tidak dibuat melalui kombinasi langsung hidrogen dan belerang karena tidak stabil pada suhu tinggi dan mudah mengalami dekomposisi menjadi unsur-unsurnya. Hidrogen sulfida biasanya dibuat dengan mereaksikan besi (II) sulfida dengan suatu asam.
FeS (s) + 2 H + (aq) → H 2 S (aq) + Fe 2+ (aq)
Hidrogen sulfida sangat mudah dikenali karena baunya yang khas. Hidrogen sulfida sangat toksik. Untungya, hidung kita mampu mendeteksi H 2 S walaupun konsentrasinya sangat rendah/konsentrasi non toksik. Molekul organik yang mengandung belerang, seperti dimetil sulfida (CH 3 ) 2 S yang memiliki bau yang mirip dan dapat terdeteksi pada konsentrasi 1 bagian per triliun, ditambahkan pada gas alam untuk deteksi kebocoran.
Belerang: Oksida, Asam Oksi, dan Anion Oksi
Belerang dioksida dihasilkan apabila belerang dibakar diudara. Gas belerang dioksida bersifat toksik bagi organisme tingkat rendah, misalnya fungi, sehingga belerang dioksida digunakan untuk sterilisasi buah dan minuman anggur. Pada tekanan 1 atm dan suhu kamar, SO 2 larut dalam air menghasilkan larutan dengan konsentrasi 1,6 M. Larutan SO 2 bersifat asam dan kita mengenalinya sebagai asam sulfit (H 2 SO 3 ). Sejumlah kecil Na 2 SO 3 dan NaHSO 3 digunakan sebagai aditif makanan untuk mencegah pembusukan oleh bakteri. Karena beberapa orang sangat alergi terhadap sulfit, semua produk makanan harus diberi label yang menunjukkan keberadaan sulfit.
Meskipun pembakaran belerang di udara utamanya menghasilkan SO 2 , sejumlah kecil SO3 juga dihasilkan. Reaksi menghasilkan SO 2 sebagai produk utama karena energi aktivasi oksidasi lebih lanjut menjadi SO 3 sangat tinggi, kecuali reaksi diberi katalis. Belerang trioksida memiliki nilai sangat penting secara komersial karena merupakan anhidrida asam sulfat. Dalam industri asam sulfat, SO 2 yang diperoleh dari pembakaran dioksidasi menjadi SO 3 dengan katalis V 2 O 5 atau Platina. SO 3 dilarutkan dalam H 2 SO 4 karena tidak segera larut dalam air dan kemudian H 2 S 2 O 7 yang dibentuk dalam reaksi ini ditambahakan kedalam air membentuk H 2 SO 4 .
SO 3 (g) + H 2 SO 4 (l) → H 2 S 2 O 7 (l)
H 2 S 2 O 7 (l) + H 2 O (l) → 2 H 2 SO 4 (l)
Asam sulfat komersial adalah H 2 SO 4 98%. Asam sulfat memiliki banyak sifat yang bermanfaat : merupakan asam kuat, mempu mendehidrasi, dan oksidator moderat. Kemampuan mendehidrasinya diilustrasikan dalam Gambar 7.10.
Asam sulfat merupakan asam kuat, namun hanya hidrogen pertamalah yang terionisasi dalam larutan akua :
H2SO4 (aq) → H + (aq) + HSO4- (aq) HSO4- (aq) == H + (aq) + SO42- (aq) Ka = 1,1 x 10 -2
Konsekuensinya, asam sulfat membentuk dua jenis senyawa: sulfat dan bisulfat (hidrogen sulfat). Ion tiosulfat (S 2 O 32- ) mirip ion sulfat dan dihasilkan melalui pendidihan suatu larutan alkali SO32- dengan belerang.
8 SO32- (aq) + S8 (s) → 8 S2O32- (aq)
6. NITROGEN
Nitrogen merupakan gas yang tersusun dari molekul N 2 , tidak berwarna, tidak berbau dan tidak berasa. Titik lelehnya -210 0 C dan mendidih pada -196 0 C. Molekul N 2 sangat tidak reaktif karena ikatan rangkap tiga yang dimilikinya (entalpi ikatan N≡N adalah 941 kJ/mol, hampir dua kali entalpi ikatan O=O). Apabila suatu materi terbakar di udara, maka yang terjadi adalah reaksi dengan O 2 bukan dengan N 2 . Tetapi apabila magnesium terbakar diudara, akan terjadi reaksi dengan N 2 membentuk magnesium nitrida (Mg 3 N 2 ). Reaksi yang sama juga terjadi pada litium, membentuk Li 3 N.
3 Mg (s) + N 2 (g) → Mg 3 N 2 (s)
Ion nitrida merupakan basa kuat, bereaksi dengan air membentuk amoniak.
Mg 3 N 2 (s) + 6 H 2 O (l) → 2 NH 3 (aq) + 3 Mg(OH) 2 (s)
Konfigurasi elekton atom nitrogen adalah [He]2s 2 2p 3 . Nitrogen memiliki bilangan oksidasi dari +5 hingga -3, seperti yang terlihat dalam Tabel 6. Bilangan oksidasi +5, 0 dan -3 merupakan bilangan oksidasi yang paling umum dan paling stabil. Karena nitrogen lebih elektronegatif dibandingkan semua unsur, kecuali fluor, oksigen dan klorin, Nitrogen memiliki bilangan oksidasi positif bila berkombinasi dengan ketiga unsur tersebut.
Pembuatan dan Kegunaan Nitrogen
Nitrogen diperoleh secara komersial melalui distilasi fraksionasi udara cair. Karena reaktivitasnya yang rendah, N 2 digunakan sebagai gas inert pelapis untuk mengeluarkan O 2 selama proses dan pengemasan makanan, industri bahan kimia, fabrikasi logam, dan produksi perangkat elektronik. N 2 cair digunakan sebagai pendingin untuk mempercepat pembekuan makanan. Penggunaan N 2 terbesar adalah pada industri pupuk yang mengandung nitrogen, yang menyediakan sumber fiksasi nitrogen. Titik awal dari fiksasi nitrogen adalah pembuatan amonia melalui proses Haber. Amonia dapat dikonversi menjadi sejumlah senyawa lain seperti yang terlihat pada Gambar 7.11.
Senyawaan Nitrogen dengan Hidrogen Amonia merupakan senyawa nitrogen terpenting. Molekul NH 3 bersifat basa dengan Kb= 1,8 x 10 -5 . Dalam laboratorium NH 3 dapat dibuat dengan mereaksikan NaOH dengan garam
amonium.
NH 4 Cl (aq) + NaOH (aq) → NH 3 (g) + NaCl (aq) + H 2 O (l)
Hidrazin (N 2 H 4 ) merupakan senyawa penting lainnya. Gambar 7.12, memperlihatkan struktrur hidrazin yang bersifat racun. Hidrazin dapat dibuat dengan mereaksikan amonia dan ion hipoklorit dalam larutan akua.
2 NH 3 (aq) + OCl – (aq) → N 2 H 2 (aq) + Cl – (aq) + H 2 O (l)
Reaksi yang terjadi sangat kompleks, melibatkan beberapa intermediat, termasuk kloramin (NH 2 Cl). Kloramin yang bersifat racun akan muncul sebagai gelembung dalam larutan apabila amonia dan pemutih klorin (yang mengandung OCl – ) dicampurkan. Penggunaan utama senyawa hidrazin dan turunannya adalah sebagai bahan bakar roket, misal metil hidrazin.
Nitrogen: Oksida dan Asam Oksi
Nitrogen membentuk tiga oksida yang umum: N 2 O, NO dan NO 2 . Nitrogen juga membentuk oksida yang tidak stabil (tidak akan dibahas pada bab ini) yaitu N 2 O 3 dan N 2 O 5 . N 2 O dapat dibuat dilaboratorium dengan memanaskan secara hati-hati amonium nitrat hingga suhu 200 0 C.
NH 4 NO 3 (s) → N 2 O (g) + 2 H 2 O (g)
Gas nitrogen monoksida sedikit toksik. Gas ini dapat dibuat dilaboratorium dengan mereduksi asam nitrat dengan menggunakan tembaga atau besi sebagai reduktor. 3 Cu (s) + 2 NO 3- (aq) + 8 H + (aq) → 3 Cu 2+ (aq) + 2 NO (g) + 4 H 2 O (l)
Nitrogen monoksida juga dapat dihasilkan melalui reaksi antara N 2 dan O 2 pada temperatur tinggi. Reaksi ini merupakan sumber signifikan polutan NO di udara. Kombinasi langsung N 2 dan O 2 tidak digukan untuk pembentukan NO secara komersial karena yield yang dihasilkan rendah, tetapan kesetimbangan Kp pada 2400 K hanya 0,05. Rute komersial untuk menghasilkan NO adalah melalui oksidasi katalitik NH 3 .
4 NH 3 (g) + 5 O 2 (g) → 4 NO (g) + 6 H 2 O (g)
Proses konversi katalitik NH 3 menjadi NO merupakan step pertama dari tiga step dalam proses Ostwald. Proses Ostwald merupakan proses komersial konversi NH 3 menjadi asam nitrat. NO mudah bereaksi dengan O 2 membentuk NO 2 apabila terkena udara.
2 NO (g) + O 2 (g) → 2 NO 2 (g)
Apabila dilarutkan dalam air, NO 2 akan membentuk asam nitrat.
3 NO 2 (g) + H 2 O (l) → 2 H + (g) + 2 NO 3 – (aq) + NO (g)
Reaksi tersebut merupakan reaksi disproporsionasi, nitrogen mengalami oksidasi dan reduksi. NO yang dihasilkan dapat diubah kembali menjadi NO 2 melalui reaksi dengan udara dan dilarutakan kembali untuk menghasilakn HNO 3 . Pada saat ini, NO diketahui sebagai suatu nurotransmitter penting dalam tubuh manusia. Nitrogen dioksida (NO 2 ) merupakan gas berwarna kuning kecoklatan. Sama seperti NO, NO 2 merupakan kompenen utama smog. NO 2 berada dalam kesetimbangan dengan N 2 O 4 .
2 NO 2 (g) → N 2 O 4 (g) ΔH 0 = -58 kJ
Dua asam oksi nitrogen yang paling umum adalah asam nitrat (HNO 3 ) dan asam nitrit (HNO 2 ). Asam nitrat merupakan asam kuat, sekaligus memiliki sifat oksidator kuat.
NO 3- (aq) + 4 H + (aq) + 3e – → NO (g) + 2 H 2 O (l) E 0 = + 0,96 V
Asam nitrat pekat akan mengoksidasi semua logam kecuali Au, Pt, Rh dan Ir. Penggunaan terbesar asam nitrat adalah untuk produksi NH 4 NO 3 (bahan pupuk). Selain itu juga, HNO 3 digunakan dalam pembuatan plastik, obat-obatan dan material eksplosif. Diantara matarial eksplosif yang dibuat dari asam nitrat adalah nitrogliserin, trinitrotoluen (TNT) dan nitroselulosa. Reaksi berikut terjadi ketika nitrogliserin meledak :
4 C 3 H 5 N 3 O 9 (l) → 6 N 2 (g) + 12 CO 2 (g) + 10 H 2 O (g) + O 2 (g)
Semua produk reaksi tersebut memiliki ikatan yang sangat kuat. Hasilnya, reaksi tersebut sangat eksotermik. Reaksi tersebut juga menghasilkan banyak molekul gas sehingga dengan panas yang dihasilkan dari reaksi akan mengekspansi volume gas dan terjadi ledakan. HNO 2 kurang stabil dibandingkan HNO 3 dan cenderung terdisproporsionasi menjadi NO dan HNO 3 . HNO 2 biasanya dibuat dari reaksi asam kuat, misal : H 2 SO 4 dengan larutan dingin
gara nitrit, seperti NaNO 2 . Asam nitrit merupakan asam lemah, Ka = 4,5 x 10 -4 .
7. UNSUR_UNSUR GOLONGAN VA LAINNYA: P, As, Sb dan Bi
Diantara unsur-unsur golongan VA selain nitrogen, posfor merupakan yang terpenting. Pada bagian ini akan dibahas kimiawi posfor, karena posfor memiliki peranan penting dalam aspek biokimia dan kimia lingkungan.
Karakteristik Umum Unsur-Unsur Golongan VA Unsur-unsur golongan VA memiliki konfigurasi elektron kulit terluar ns 2 np 3 , dimana n berkisar antara 2 sampai 6. Konfigurasi gas mulia dihasilkan dari penambahan 3 elektron membentuk bilangan oksidasi -3. Namun walaupun demikian senyawa ionik yang mengandung ion X 3- jarang ditemui. Umumnya, unsur golongan VA mencapai oktet dengan membentuk ikatan kovalen. Bilangan oksidasi bervariasi dari -3 hingga +5, tergantung jenis
ikatan dan jumlah atom yang terikat.
Karena elektronegatifitasnya yang rendah, Posfor lebih sering ditemukan berada dalam keadaan oksidasi positif dibandingkan nitrogen. Sifat oksidator senyawa dimana posfor memiliki bilangan oksidasi +5 tidak sekuat pada senyawa nitrogen. Sebaliknya, senyawa dengan bilangan oksidasi posfor -3 merupakan reduktor yang lebih kuat dibandingkan senyawa nitrogen yang bersesuaian.
Beberapa sifat penting unsur golongan VA terdapat dalam Tabel 7. Kecenderungan umum yang dijumpai adalah sama seperti yang telah kita lihat untuk golongan lainnya : Ukuran atom dan karakter logam meningkat seiring meningkatnya nomor atom dalam satu golongan.
Keberadaan, Isolasi dan Sifat Posfor
Posfor umumnya ditemukan dalam bentuk mineral posfat. Sumber utama posfor adalah batuan posfat, yang mengandung posfat sebagai Ca 3 (PO 4 ) 2 . Unsur posfat diproduksi secara komersial melalui reduksi kalsium posfat dengan karbon dengan adanya silikat.
2 Ca 3 (PO 4 ) 2 (s) + 6 SiO 2 (s) + 10 C (s) → P 4 (g) + 6 CaSiO 3 (l) + 10 CO (g)
Posfor yang dihasilkan merupakan posfor putih. Posfor putih terdiri dari tetrahedral P 4 (Gambar 7.13). Sudut ikatan 60 0 menyebabkan terdapat tegangan pada ikatan sehingga kurang stabil. Hal ini konsisten dengan sifat posfor putih yang sangat reaktif. Allotropi ini mudah terbakar jika terkena udara. Apabila dipanaskan tanpa udara hingga kira-kira 400 0 C, posfor putih berubah menjadi allotropi yang lebih stabil, posfor merah, yang tidak terbakar dengan udara. (Gambar 7.14).
Halida Posfor
Posfor membentuk sejumlah senyawa dengan halogen, dan yang paling penting adalah trihalida dan pentahalida. Posfortriklorida (PCl 3 ) merupakan senyawa yang paling penting secara komersial. PCl 3 digunakan unutk membuat sejumlah produk termasuk sabun, deterjen, plastik dan insektisida. Posfor klorida, bromida dan iodida dapat dibuat langsung dengan oksidasi posfor dengan halogen. PCl 3 merupakan cairan pada suhu kamar, dibuat dengan mereaksikan upa kering gas klorin dengan posfor putih atau posfor merah.
2 P (s) + 3 Cl 2 (g) → 2 PCl 3 (l)
Jika digunakan klorin berlebih, terjadi suatu kesetimbangan antara PCl 3 dan PCl 5 .
PCl 3 (l) + Cl 2 (g) → PCl 5 (s)
Posfor halida dapat mengalami hidrolisis jika terjadi kontak dengan air. Reaksi ini sangat mudah terjdai dan kebanyakan posfor halida berasap di udara karena terjadi reaksi dengan uap air. Jika digunakan air yang berlebih, produk yang dihasilkan adalah asam oksi dan hidrogen halida.
PBr 3 (l) + 3 H 2 O (l) → H 3 PO 3 (aq) + 3 HBr (aq) PCl 5 (l) + 4 H 2 O (l) → H 3 PO 4 (aq) + 5 HCl (aq)
Senyawa Oksi Posfor
Posfor (III) Oksida (P 4 O 6 ) dihasilkan apabila posfor putih dioksidasi dengan oksigen yang terbatas. Apabila digunakan oksigen berlebih akan dihasilkan posfor (V) oksida (P 4 O 10 ). Struktur kedua senyawa tersebut ditunjukkan dalam Gambar 7.15.
Posfor (V) oksida merupakan anhidrida asam posfat (H 3 PO 4 ), suatu asam lemah triprotik. P 4 O 10 memiliki afinitas sangat tinggi terhadap air sehinga sering digunakan sebagai agen pengering. Posfor (III) oksida merupakan anhidrida asam posfit (H 3 PO 3 ). Struktur kedua asam tersebut diperlihatkan pada Gambar 7.16.
Salah satu karakter posfor dan asam posfat adalah kecenderungannya untuk mengalami reaksi kondensasi apabila dipanaskan. Reaksi kondensasi adalah reaksi dimana dua atau lebih molekul berkombinasi membentuk molekul yang lebih besar melalui eliminasi molekul kecil, seperti H 2 O. Contohnya, dua molekul H 3 PO 4 bergabung membentuk H 4 P 2 O 7 melepaskan molekul H 2 O.
Senyawa-senyawa posfor memiliki peranan penting dalam sistem biologi. Posfor berada dalam bentuk gugus posfat pada RNA dan DNA, molekul yang bertanggungjawab pada kontrol biosintesa protein dan transmisi informasi genetik. Posfor juga terdapat dalam adenosin triposfat (ATP), yang berfungsi sebagi penyimpan energi yang dibutuhkan sel.
8. KARBON
Karbon hanya menyusun 0,027% kerak bumi, jadi bukanlah unsur yang melimpah. Meskipun beberapa karbon berada dalam bentuk elementalnya seperti grafit dan intan, kebanyakan karbon ditemukan dalam bentuk kombinasi dengan unsur lain (senyawa). Hampir separuhnya ditemukan dalam senyawa karbonat, seperti CaCO 3 . Karbon juga ditemukan dalam batubara, minyak bumi dan gas alam.
Bentuk Elemental Karbon
Karbon terdapat di alam dalam empat allotropi kristal: intan, grafit, fulleren dan carbon nanotube (Gambar 7.17). Grafit merupakan material yang berwarna hitam, lunak dan bersifat konduktor listrik. Grafit tersusun dari lembaran paralel atom karbon yang berinteraksi melalui gaya London. Intan merupakan material bening, padatan yang keras, tersusun oleh atom karbon membentuk suatu jaringan kovalen. Intan lebih rapat dibandingkan grafit ( d intan = 3,51 g/cm 3 , d grafit = 2,25 g/cm 3 ). Pada tekanan dan suhu yang sangat tinggi (kira-kira 100.000 atm dan 3000 0 C) grafit dapat berubah menjadi intan. Hampir 3 x 10 4 kg intan disintesa setiap tahun, terutama untuk keperluan alat pemotongan (cutting), pengasahan (grinding), dan penggosokan (polishing). Fullerena merupakan bentuk molekular karbon yang ditemukan pada pertengahan 1980. Fullerena terdiri dari molekul-molekul individu seperti C 60 dan C 70 . Molekul C 60 mirip dengan bola yang digunakan pada pertandingan sepak bola. Hingga sekarang, banyak kelompok penelitian yang mengeksplorasi sifat kimia fullerena. Bentuk molekular yang dekat hubungannya dengan fullerena adalah carbon nanotube, yang tersusun oleh lapisan tunggal (single layer) atau berlapis (multiple layers) lapisan karbon yang digulung membentuk silinder, seperti yang ditunjukkan Gambar 7.17.
Grafit berada dalam dua bentuk amorfous, yaitu Carbon black dan charcoal. Carbon black dibentuk apabila hidrokarbon, misalnya metana, dibakar dalam kondisi suplai oksigen yang sangat terbatas.
CH 4 (g) + O 2 (g) → C (s) + 2 H 2 O (g)
Carbon black digunakan sebagai pigmen hitam pada tinta, namun sejumlah besar juga digunakan pada pembuatan ban mobil. Charcoal dihasilkan apabila kayu dipanaskan tanpa adanya udara. Charcoal memiliki struktur yang sangat terbuka, menghasilkan suatu luas permukaan yang sangat besar per satuan massa. Charcoal yang diaktifkan, suatu bentuk bubuk yang permukaannya dibersihkan dengan pemanasan menggunakan uap, digunakan secara luas untuk mengadsorbsi molekul. Charcoal digunakan sebagai filter untuk menghilangkan bau tak sedap dari udara dan pengotor pada air.
Oksida Karbon
Karbon membentuk dua oksida utama, yaitu karbon monoksida (CO) dan karbon dioksida (CO 2 ). Karbon monoksida dihasilkan ketika karbon atau hidrokarbon dibakar dalam kondisi suplai oksigen terbatas.
2 C (s) + O 2 (g) → 2 CO (g)
Karbon monoksida merupakan gas yang tidak berbau, tidak berasa dan tidak berwarna. Karbon monoksida bersifat racun karena dapat berikatan dengan hemoglobin dalam darah sehingga mengganggu transpor oksigen. Keracunan tahap rendah mengakibatkan sakit kepala dan mengantuk, keracunan tingkat tinggi dapat mengakibatkan kematian. Mesin mobil menghasilkan karbon monoksida, yang merupakan salah satu polutan udara.
Karbon monoksida merupakan senyawa yang tidak biasa. strukturnya memiliki sepasang elektron bebas pada atom C. Karbon monoksida juga isoelektronik dengan N 2 , sehingga mungkin anda akan mengira bahwa CO akan bersifat tidak reaktif seperti N 2 . Selain itu, kedua senyawa tersebut memiliki energi ikatan yang sangat tinggi (C≡O : 1072 kJ/mol, dan 941 kJ/mol untuk N≡N). Karena muatan inti yang rendah pada atom karbon (jika dibandingkan dengan N atau O), pasangan elektron bebas pada atom C tidak ditarik sekuat seperti pada N dan O. Akibatnya CO lebih mudah berfungsi sebagai donor pasangan elektron (basa lewis) dibandingkan N 2 . Karbon monoksida membentuk sejumlah ikatan kovalen dengan logam transisi yang dikenal sebagai karbonil logam. Contohnya adalah Ni(CO) 4 , senyawa ini bersifat toksik, dibuat dengan pemanasan logam nikel dengan keberadaan gas CO. Pembentukan karbonil logam merupakan tahap pertama dalam katalisis logam transisi yang melibatkan reaksi dengan CO.
Karbon monoksida memiliki beberapa kegunaan komersial. Karena sifatnya yang mudah terbakar membentuk CO 2 , karbon monoksida digunakan sebagai bahan bakar.
2 CO (g) + O 2 (g) → 2 CO 2 (g) ΔH 0 = -566 kJ
Karbon monoksida juga merupakan reduktor penting, digunakan secara luas di bidang metalurgi untuk mereduksi oksida logam, seperti oksida besi.
Fe 3 O 4 (s) + 4 CO (g) → 3 Fe (s) + 4 CO 2 (g)
Karbon monoksida juga digunakan dalam preparasi beberapa senyawa organik, seperti metanol. Karbon dioksida dihasilkan apabila material yang mengandung karbon dibakar dengan oksigen yang berlebih. Karbon dioksida juga dihasilkan apabila senyawa karbonat dipanaskan.
C 2 H 5 OH (l) + 3 O 2 (g) → 2 CO 2 (g) + 3 H 2 O (g) CaCO 3 (s) → CaO (s) + CO 2 (g)
Sejumlah besar karbon dioksida juga dapat diperoleh sebagai by-product pada fermentasi gula. Di laboratorium, karbon dioksida dapat dihasilkan dari reaksi suatu asam dengan karbonat.
C 6 H 12 O 6 (aq) → 2 C 2 H 5 OH (aq) + 2 CO 2 (g) CO 32- (aq) + 2 H + (aq) → CO 2 (g) + H 2 O (l)
Karbon dioksida merupakan gas yang tidak berwarna dan tidak berbau. Karbon dioksida merupakan komponen minor di atmosfer bumi, namun memiliki kontribusi utama yang disebut efek rumah kaca. Meskipun tidak bersifat toksik, konsentrasi CO 2 tinggi meningkatkan laju respirasi dan dapat menyebabkan mati lemas. CO 2 dapat dengan mudah dicairkan dengan proses kompresi (pemberian tekanan). Apabila didinginkan pada tekanan atmosfer, CO 2 akan terkondensasi menjadi padatan. Pada kondisi tekanan atmosfer CO 2 padat menyublim pada suhu -78 0 C.
Asam karbonat dan Karbonat
Karbon dioksida cukup larut dalam air pada kondisi tekanan atmosfer. Larutan yang dihasilkan bersifat asam karena terbentuknya asam karbonat.
CO2 (aq) + H2O (l) = H2CO3 (aq)
Asam karbonat merupakan asam diprotik lemah. Karakter asam ini menyebabkan minuman berkarbonasi memiliki rasa sedikit asam. Meskipun asam karbonat tidak dapat diisolasi sebagai senyawa murni, hidrogen karbonat (bikarbonat) dan karbonat dapat diperoleh dengan netralisasi larutan asam karbonat. Netralisasi sebagian akan menghasilkan HCO 3- , dan netralisasi sempurna menghasilkan CO 32- . Ion HCO 3- memiliki sifat basa yang lebih kuat dibandingkan sifat asamnya (Kb = 2,3 x 10 -8 , Ka = 5,6 x 10 -11 ). Ion karbonat merupakan basa yang jauh lebih kuat dibandingkan ion bikarbonat (Kb = 1,8 x 10 -4 ).
Mineral yang mengandung ion karbonat sangatlah berlimpah. Mineral karbonat yang utama adalah kalsit (CaCO 3 ), magnesite (MgCO 3 ), dolomite (MgCa(CO 3 ) 2 ), dan siderite (FeCO 3 ).
Kalsit merupakan mineral utama penyusun batu kapur. Meskipun CaCO 3 sukar larut dalam air murni, CaCO 3 larut dengan mudah dalam larutan asam, membebaskan gas CO2 .
CaCO 3 (s) + 2 H + (aq) → Ca 2+ (aq) + CO2 (g) + H 2 O (l)
Karena air yang mengandung CO2 terlarut bersifat sedikit asam, CaCO 3 larut perlahan-lahan dalam medium ini :
CaCO 3 (s) + H 2 O (l) + CO2 (g) → Ca 2+ (aq) + 2 HCO3-(aq)
Karbida
Senyawa biner karbon dengan logam logam, metalloid dan terkadang non logam disebut karbida. Terdapat tiga jenis karbida : ionik, interstitial dan kovalen. Semakin aktif logam, maka akan dihasilkan karbida ionik. Karbida ionik yang paling umum mengandung ion asetilida (C 22- ), yang memiliki ikatan karbon rangkap tiga. Karbida ionik yang paling penting adalah kalsium karbida (CaC 2 ), yang dihasilkan melalui reduksi CaO oleh karbon pada suhu tinggi.
2 CaO (s) + 5C (s) → 2 CaC2 (s) + CO2 (g)
Ion karbida merupakan basa kuat, bereaksi dengan air membentuk asetilena (H-C≡C-H), sesuai reaksi :
CaC2 (s) + 2 H 2 O (l) → Ca(OH)2 (aq) + C2H2 (g)
Senyawa Anorganik Karbon Lainnya Hidrogen sianida, HCN, merupakan gas yang sangat beracun. Dihasilkan dari reaksi garam sianida, misalnya NaCN, dengan suatu asam. Larutan akua HCN dikenal sebagai asam hidrosianat, netralisasi larutan dengan basa, misal NaOH, akan menghasilkan garam sianida, NaCN. Sianida digunakan dalam manufaktur plastik, seperti nilon dan Orlon®. Ion CN – membentuk kompleks yang sangat stabil dengan logam transisi. Karbon disulfida, CS 2 , merupakan pelarut yang penting di industri wax, selulosa, dan senyawa non polar lainnya. CS 2 merupakan cairan tidak berwarna, mudah menguap (volatil),
dengan titik didih 46,3 0 C. Uap CS 2 bersifat racun dan mudah terbakar.
9. UNSUR-UNSUR GOLONGAN IVA LAINNYA : Si, Ge, Sn dan Pb
Unsur-unsur lain dalam golongan IVA selain karbon adalah Silikon, germanium, timah dan timbal. Karbon merupakan non logam; silikon dan germanium merupakan metalloid, sedangkan timah dan timbal merupakan logam.
Karakteristik Umum Unsur-Unsur Golongan IVA Beberapa sifat unsur-unsur golongan IVA diberikan dalam Tabel 8. Unsur memiliki konfigurasi elektron kulit terluar ns 2 np 2 . Keelektronegatifan unsur golongan IV A umumnya rendah; karbida yang secara formal mengandung ion C 4- ditemukan hanya dalam beberapa senyawa karbon dengan logam yang sangat aktif. Pembentukan ion +4 tidak terjadi pada setiap unsur, energi ionisasinya terlalu tinggi. Keadaan oksidasi +2 ditemukan dalam kimiawi germanium, timah dan timbal. Kebanyakan senyawaan unsur golongan IVA merupakan senyawa kovalen. Karbon membentuk maksimum empat ikatan. Anggota yang lainnya mampu
membentuk koordinasi yang lebih besar melalui kulit valensi yang diperluas.
Keberadaan dan Preparasi Silikon
Silikon merupakan unsur kedua terbanyak di kerak bumi setelah oksigen. Silikon berada dalam bentuk SiO2 dan sejumlah mineral silikat lainnya. Si diperoleh dari reduksi lelehan silikon dioksdia dengan karbon pada suhu tinggi.
SiO2 (l) + 2 C (s) → Si (l) + 2 CO2 (g)
Silikon memiliki struktur mirip intan. Kristal silikon berwarna abu-abu yang melelah pada 1410 0 C. Si bersifat semikonduktor sehingga digunakan dalam pembuatan transistor dan sel surya. Untuk dapat digunakan sebagai semikonduktor, silikon harus memiliki kemurnian yang sangat tinggi, kadar pengotor kurang dari 10 -7 % (1ppb). Salah satu cara permurnian Si adalah dengan mereaksikannya dengan Cl 2 membentuk SiCl 4 . SiCl 4 merupakan cairan volatil yang dimurnikan dengan distilasi fraksionasi dan kemudian diubah kembali menjadi Si melalui reduksi dengan H 2 .
SiCl 4 (g) + 2 H 2 (g) → Si (s) + 4 HCl (g)
Silikat
Silikon dioksida dan senyawa lain yang mengandung silikon dan oksigen menyusun hampir 90% kerak bumi. Silikat merupakan senyawa dimana atom silikon dikelilingi oleh empat atom O secara tetrahedra, seperti yang terlihat pada Gambar 18.a . Dalam silikat, silikon berada dalam keadaan oksidasi yang umum yaitu +4. Ion SiO 44- , yang dikenal sebagai orthosilikat, dijumpai sangat sedikit dalam mineral silikat. Tetrahedral silikat merupakan “building block” struktur mineral. Masing-masing tetrahedral dihubungkan oleh atom oksigen.
Kita dapat menggabungkan dua tetrahedral silikat dengan pemakaian bersama satu atom oksigen, seperti yang terlihat pada Gambar 7.18.b. Struktur yang dihasilkan disebut ion disilikat, memiliki dua atom Si dan tujuh atom O. Bilangan oksidasi atom Si dan O berturut-turut adalah +4 dan -2. Dalam kebanyakan struktur silikat, sejumlah besar tetrahedral berkombinasi membentuk rantai, lembaran, atau struktur tiga dimensi, seperti yang terlihat pada Gambar 7.19.
10. BORON
Boron merupakan satu-satunya unsur golongan IIIA yang termasuk non logam. Unsur boron memiliki suatu struktur jaringan (network) yang diperluas. Titik lelehnya 2300 0 C, merupakan intermediet antara karbon (3550 0 C) dan silikon (1410 0 C). Konfigurasi elektron boron adalah [He]2s 2 2p 1 .
Dalam suatu kelompok senyawa yang disebut borana, molekul hanya tersusun oleh boron dan hidrogen. Borana paling sederhana adalah BH 3 . Molekul ini hanya memiliki enam elektron valensi, sehingga merupakan suatu pengecualian aturan oktet. Akibatnya, BH 3 bereaksi dengan molekul BH 3 lain membentuk diborana, B 2 H 6 , Gambar 7.20. Reaksi ini dapat ditinjau sebagai reaksi asam basa Lewis, dimana satu pasangan elektron ikatan B-H pada masing-masing molekul didonasikan ke molekul lainnya. Molekul diborana merupakan molekul yang tidak biasa karena atom hidrogen membentuk dua ikatan.
Pemakaian bersama atom hidrogen antara dua atom boron mengganti kekurangan elektron valensi pada setiap atom boron. Meskipun demikian, diborana merupakan molekul sangat reaktif, terbakar secara spontan di udara. Reaksi B 2 H 6 dengan O2 sangat eksotermik.
B 2 H 6 (g) + 3 O2 (g) → B 2 O 3 (s) + 3 H 2 O (g) ΔH 0 = -2030 kJ
Borana yang lain seperti pentaborana, B 5 H 9 , juga sangat reaktif. Boron dan hidrogen juga membentuk sederetan anion, disebut anio boran. Garam borohidrida (BH 4- ) digunakan secara luas sebagai reduktor. Natrium borohidrida (NaBH 4 ) digunakan sebagai reduktor untuk senyawa organik tertentu.
Satu-satunya oksida boron yang penting adalah oksida borat (B2O3). Senyawa ini merupakan anhidrida asam borat, yang dapat ditulis sebagai H3BO3 atau B(OH)3 . Asam borat merupakan asam sangat lemah (Ka = 5,8 x 10 -10 ), larutan H3BO3 sering digunakan dalam obat mata. Pada pemanasan, asam borat kehilangan molekul air melalui reaksi kondensasi yang mirip seperti yang terjadi pada Posfor :
4 H3BO3 (s) → H2B4O7 (s) + 5H2O (g)
Asam diprotik H2B4O7 disebut asam tetraborat. Garam natrium terhidrat hidrat, Na2B4O7 .10H2O, disebut boraks. Larutan boraks bersifat basa dan digunakan dalam produk pembersih dan laundry.
Daftar Pustaka
Brown, Lemay, Bursten, Murphy, “Chemistry The Central Science”, 11th eds, Pearson Educational International, 2009, hal 930-979.
Gallery Unsur Logam Dan Non Logam
 Blog Cikgu Jumrah Unsur Logam Dan Bukan Logam
Blog Cikgu Jumrah Unsur Logam Dan Bukan Logam
 Unsur Nonlogam Nomor Atom Ikatan Kimia Dan Rumus Kimia
Unsur Nonlogam Nomor Atom Ikatan Kimia Dan Rumus Kimia
 Pengklasifikasian Senyawa Unsur Campuran Pengertian Ciri
Pengklasifikasian Senyawa Unsur Campuran Pengertian Ciri
 Tata Nama Senyawa Kimia Biner Yang Tersusun Atas Unsur Logam
Tata Nama Senyawa Kimia Biner Yang Tersusun Atas Unsur Logam
 Unsur Logam Dan Ion Yang Sering Digunakan Di Kehidupan
Unsur Logam Dan Ion Yang Sering Digunakan Di Kehidupan
 Unsur Unsur Logam Dan Non Logam Terpenting Pptx Powerpoint
Unsur Unsur Logam Dan Non Logam Terpenting Pptx Powerpoint
 A Unsure Logam Dan Unsure Logam B Unsure Non Logam Dan Non
A Unsure Logam Dan Unsure Logam B Unsure Non Logam Dan Non
 Menentukan Rumus Molekul Suatu Senyawa Yang Terbentuk Dari
Menentukan Rumus Molekul Suatu Senyawa Yang Terbentuk Dari
 Doc Sejarah Perkembangan Sistem Periodik Unsur Mega
Doc Sejarah Perkembangan Sistem Periodik Unsur Mega
 Doc Periodik Kimia Naufal Riansyaputra Academia Edu
Doc Periodik Kimia Naufal Riansyaputra Academia Edu
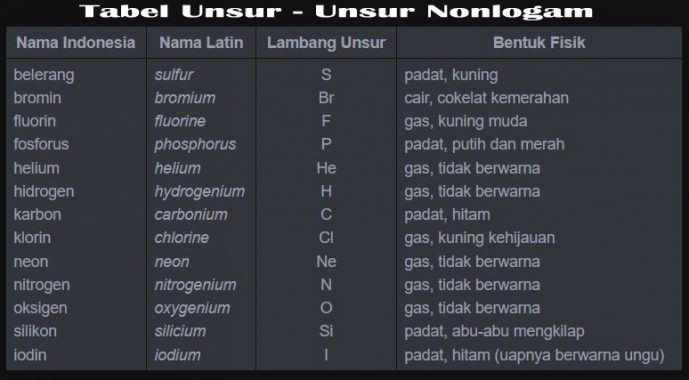
 20 Contoh Non Logam Beserta Nama Latin Dan Lambangnya
20 Contoh Non Logam Beserta Nama Latin Dan Lambangnya
 Sistem Periodik Unsur Kimia Tabel Sifat Dan Gambar Hd
Sistem Periodik Unsur Kimia Tabel Sifat Dan Gambar Hd
 Senyawa Kimia Yang Terbentuk Dari Unsur Logam Dan Non Logam
Senyawa Kimia Yang Terbentuk Dari Unsur Logam Dan Non Logam
 Unsur Senyawa Dan Campuran Pengertian Sifat Jenis Contoh
Unsur Senyawa Dan Campuran Pengertian Sifat Jenis Contoh
 Unsur Senyawa Campuran Pengertian Sifat Contoh
Unsur Senyawa Campuran Pengertian Sifat Contoh
 Tabel Periodik Unsur Kimia Lengkap Dan Keterangan Gambar Hd
Tabel Periodik Unsur Kimia Lengkap Dan Keterangan Gambar Hd
 Materi Pembelajaran Unsur Logam Dan Non Logam Ppt Powerpoint
Materi Pembelajaran Unsur Logam Dan Non Logam Ppt Powerpoint
 Penjelasan Sifat Unsur Unsur Logam Semi Logam Dan Non Logam
Penjelasan Sifat Unsur Unsur Logam Semi Logam Dan Non Logam








0 Response to "Unsur Logam Dan Non Logam"
Post a Comment